Авторы: Барбараш О.Л. 1, 2 , Кашталап В.В. 1, 2 , Тарасов Р.С.
3 1 НИИ КПССЗ, Кемерово, Россия 2 ФГБОУ ВО КемГМУ Минздрава России, Кемерово, Россия 3 ФГБНУ НИИ КПССЗ, Кемерово, Россия Острые коронарные синдромы (ОКС) остаются одной из основных причин смертности и инвалидизации в экономически развитых странах, включая Российскую Федерацию.
Известно, что сердечная недостаточность в остром периоде инфаркта миокарда (ИМ) повышает риск развития госпитальной летальности в 3‒4 раза и на 55% ‒ в первые 30 дней после ОКС. Коррекция сердечной недостаточности у этой группы больных носит обязательный, жизнеспасающий характер.
Особенно актуален подбор медикаментозной терапии у пациентов уязвимой группы – пожилого и старческого возраста. Представленный в статье клинический случай являет пример реальной клинической практики, когда доступная медикаментозная терапия, улучшающая прогноз пожилых пациентов с ОКС, не всегда используется практическими врачами.
В данном клиническом примере обращает на себя внимание факт неиспользования как после первичного, так и после повторного ИМ на госпитальном и амбулаторном этапах терапевтических возможностей антагонистов минералокортикоидных рецепторов.
В статье приводится обзор препарата эплеренон – первого и пока единственного селективного блокатора рецепторов альдостерона, зарегистрированного специально для терапии сердечной недостаточности после ИМ, длительный прием которого связан с улучшением выживаемости при добавлении к стандартной терапии при сердечной недостаточности после перенесенного ИМ, в т. ч. у пациентов пожилого возраста с ОКС.
Ключевые слова: пожилой пациент, антагонисты минералокортикоидных рецепторов, острый коронарный синдром, инфаркт миокарда, хроническая сердечная недостаточность, эплеренон.
Для цитирования: Барбараш О.Л., Кашталап В.В., Тарасов Р.С. Пациент пожилого возраста с инфарктом миокарда, осложненным сердечной недостаточностью. Возможности медикаментозной терапии в улучшении прогноза. РМЖ. 2017;3:147-152.
Elderly patient with myocardial infarction complicated by heart failure. Medical therapy options for prognosis improvement
Barbarash O.L.1.2, Kashtalap V.V.1,2, Tarasov R.S.1
1 Research Institute of complex problems of cardiovascular diseases, Kemerovo
2 Kemerovo State Medical University Acute coronary syndromes (ACS) are the leading causes of death and disability in developed countries, including the Russian Federation. It is known that heart failure in the acute period of myocardial infarction (MI) increases the risk of in-hospital mortality by 3-4 times and by 55% in the first 30 days after ACS. Correction of heart failure in this group of patients is mandatory and has a life-saving character. The selection of drug therapy is particularly important for the patients of “vulnerable” groups – the elderly and senile age. The article presents a clinical case as an example of real clinical practice which illustrates the situation when the available drug therapy that improves the prognosis for elderly patients with ACS is not always used by practical doctors. This clinical case draws attention to the fact of non-use, after both the initial and repeated myocardial infarction, of the mineralocorticoid receptors antagonists during in-hospital and outpatient therapy. The article provides an overview of the drug Eplerenone – the first and the only selective blocker of aldosterone receptors, which is registered especifically for the treatment of heart failure after myocardial infarction, and its long-term use is associated with the survival growth when added to a standard heart failure therapy after myocardial infarction, including elderly patients with ACS.
Key words: elderly patient, mineralocorticoid receptor antagonists, acute coronary syndrome, myocardial infarction, chronic heart failure, Eplerenone
For citation: Barbarash O.L., Kashtalap V.V., Tarasov R.S. Elderly patient with myocardial infarction complicated by heart failure. Medical therapy options for prognosis improvement // RMJ. 2017. № 3. P. 147–152.
В статье рассмотрена проблема пациента пожилого возраста с инфарктом миокарда
Инфаркт миокарда (ИМ) является актуальной проблемой современной медицины, поскольку заболеваемость, инвалидизация и смертность, обусловленные им, остаются на высоком уровне в развитых странах [1]. По данным официальной статистики, в России с 2002 по 2012 г. смертность от болезней системы кровообращения снизилась на 18,7%, смертность от ишемической болезни сердца – на 8,3%, при этом смертность от ИМ увеличилась на 7,3% [2]. Экономический ущерб от ИМ и инсультов в России составляет ежегодно до 30 млрд руб. [3]. Вследствие этого значительные организационные и лечебно-профилактические мероприятия на государственном уровне предпринимаются именно в отношении улучшения подходов к ведению пациентов с ИМ. Задача практикующего врача ‒ назначать терапию, улучшающую выживаемость пациента с ИМ в каждом конкретном случае. Известно, что сердечная недостаточность в остром периоде ИМ повышает риск развития госпитальной летальности в 3‒4 раза и на 55% ‒ в первые 30 дней после острого коронарного синдрома (ОКС) [4]. Профилактика и коррекция клинических проявлений сердечной недостаточности у этой группы больных носит обязательный, жизнеспасающий характер, применение лекарственных препаратов с этой целью может значительно снизить раннюю и отдаленную смертность от ИМ. Особенно актуален подбор медикаментозной терапии у пациентов уязвимой группы – пожилого и старческого возраста. Представленный в статье клинический случай являет пример реальной клинической практики, когда доступная медикаментозная терапия, улучшающая прогноз пожилых пациентов с ОКС, не всегда используется практическими врачами.
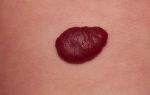
Пациент В., 76 лет, пенсионер, рост 160 см, вес 60 кг. Поступил в приемное отделение Кузбасского кардиологического центра 10 февраля 2016 г. по экстренным показаниям с жалобами на рецидивирующие в течение последних 2-х дней приступы сердечной астмы в покое, нарастающую слабость. Из анамнеза: артериальная гипертензия регистрируется в течение 20 лет, максимальные цифры артериального давления (АД) ‒ до 180/100 мм рт. ст. На фоне лечения адаптирован к АД 125/90 мм рт. ст. В 2005 г. перенес острое нарушение мозгового кровообращения по ишемическому типу с остаточными явлениями грубого неврологического дефицита (афазии и гемипареза справа). Передвижения пациента ограничены квартирой. В 2008 г. без предшествующей стенокардии перенес ИМ передней локализации. Тогда же проведена коронарография, выявившая многососудистое поражение коронарных артерий (стеноз ствола левой коронарной артерии (ЛКА) в дистальном сегменте ‒ 75%, субтотальный стеноз передней нисходящей артерии (ПНА) ‒ 99%). Коллегиально определена консервативная тактика ведения пациента в связи с его отказом от последующего коронарного шунтирования. После выписки из стационара в постинфарктном периоде выявлена дисфункция левого желудочка со снижением фракции выброса до 42% и формированием постинфарктной тромбированной аневризмы верхушки. В течение последующих лет пациент отмечал одышку в пределах II‒III функционального класса сердечной недостаточности по классификации NYHA. Постоянно принимает: эналаприл 20 мг/сут; ацетилсалициловую кислоту 150 мг/сут; карведилол 25 мг/сут; симвастатин 40 мг/сут. Настоящее ухудшение развилось в виде сердечной астмы в течение 2-х суток. На догоспитальном этапе 10.02.2016 по ЭКГ зафиксирован пароксизм желудочковой тахикардии со снижением АД до 80/60 мм рт. ст., купированный внутривенным введением амиодарона 300 мг (рис. 1). Кроме того, на этапе скорой медицинской помощи внутривенно введены следующие препараты: морфин 1,0% 1,0 мг; фуросемид 40 мг; дофамин инфузионно 5,0 мл на 250 мл хлорида натрия 0,9%. Из сопутствующей патологии: в течение 12 лет язвенная болезнь желудка, в настоящее время вне обострения, и в течение 7 лет хронический пиелонефрит на фоне доброкачественной гиперплазии предстательной железы и мочекаменной болезни. При поступлении пациент предъявлял жалобы на одышку в положении сидя, слабость. При осмотре врачом приемного отделения определено ясное сознание и моторная афазия. АД ‒ 118/70 мм рт. ст., частота сокращений сердца (ЧСС) – 62 уд/мин, при аускультации тоны сердца ритмичные, в нижних отделах легких мелкопузырчатые влажные хрипы, слева ослабление везикулярного дыхания, частота дыхания (ЧД) – 21 в минуту. Представлены результаты обследования пациента.
Общий анализ крови: гемоглобин – 167 г/л; эритроциты – 5,36×1012/л; лейкоциты – 10,5×109/л; тромбоциты ‒ 326×109 /л.
Биохимический анализ крови: тропонин I – 2,99 нг/мл (норма до 0,4 нг/мл); калий сыворотки – 4,0 ммоль/л; натрий – 141 ммоль/л; сахар крови – 10,2 ммоль/л (тощаковая гликемия утром следующих суток – 5,5 ммоль/л); креатинкиназа общей фракции – 488 Ед/л; кретинкиназа МВ-фракции – 52,2 Ед/л (норма до 25 Ед/л); креатинин крови – 112 мкмоль/л (норма 62‒124 мкмоль/л); мочевина – 13,1 ммоль/л (норма 3,8‒7,3 ммоль/л); общий холестерин – 5,7 ммоль/л. Коагулограмма: РФМК – 5,5 мг% (норма до 3 мг%); АЧТВ – 23 с; МНО ‒ 1,22. Кислотно-щелочное состояние: рН ‒ 7,236; рСО2 ‒ 44,7 мм рт. ст.; рО2 – 23 мм рт. ст.; ВEd = –8,5 (метаболический ацидоз). Скорость клубочковой фильтрации: по формуле MDRD: 58,8 мл/мин/1,73 м2; по формуле CKD-EPI: 54 мл/мин/1,73 м2.
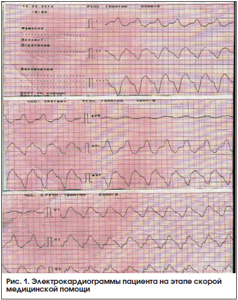
Заключение по ЭКГ в приемном отделении: ритм синусовый, ЧСС 67 уд/мин. Поздние одиночные мономорфные желудочковые экстрасистолы. АВ-блокада I степени. Рубцовые изменения в передней стенке левого желудочка с аневризмой. Необходимо исключить течение повторного ИМ в передней стенке левого желудочка в зоне рубца (рис. 2).
ЭхоКГ от 10.02.2016: КДР ‒ 5,8 см; левый желудочек по Тейхольцу: конечный систолический размер ‒ 5,0 см, конечный диастолический объем ‒ 167 мл, конечный систолический объем ‒ 118 мл, фракция выброса левого желудочка ‒ 29%; размер левого предсердия ‒ 4,4 см; межжелудочковая перегородка ‒ 1,1 см; аорта ‒ 3,8 см; ударный объем – 49 мл. Ультразвуковые признаки аневризмы верхушки левого желудочка на участке 5 см. На митральном клапане выявлена регургитация II‒III степени. На аортальном клапане – регургитация в выходном отделе левого желудочка, кальциноз створок. Градиент на аортальном клапане ‒ 9 мм рт. ст. На трикуспидальном клапане определена регургитация I степени. Систолическое давление в легочной артерии – 38 мм рт. ст. Заключение: гипертрофия и дилатация левого желудочка, левого предсердия, сократительная способность миокарда левого желудочка выраженно снижена. Склероз аорты с поражением аортального клапана, относительная недостаточность митрального клапана. Легочная гипертензия. Рентгенография органов грудной клетки от 10.02.2016: расширение сердца в поперечнике, усиление легочного рисунка в S10 слева, как проявление левосторонней нижнедолевой пневмонии (рис. 3). Диагноз, выставленный при поступлении пациента в стационар
Основной диагноз: ишемическая болезнь сердца. ИМ от 9‒10.02.2016, повторный (2), Q-необразующий, передний распространенный, без подъема сегмента ST, астматический вариант начала, осложненный пароксизмом желудочковой тахикардии от 10.02.
2016 (купирована медикаментозно на этапе скорой медицинской помощи), сердечной астмой, Killip II. Постинфарктный (2008) кардиосклероз. Хроническая сердечная недостаточность IIА, функциональный класс IV. Относительная недостаточность митрального клапана III степени.
Хроническая тромбированная аневризма левого желудочка.
Фоновая патология: гипертоническая болезнь III, риск 4 (очень высокий). Поздний восстановительный период острого нарушения кровообращения в 2005 г. Моторная афазия. Правосторонний гемипарез. Сопутствующая патология:
Консервативное лечение облитерирующих заболеваний нижних конечностей
Цель консервативного лечения облитерирующих заболеваний нижних конечностей заключается в нормализации или уменьшения нарушения артериального кровообращения, профилактике и предотвращения рецидива развития тромбоза, сохранения конечности.
При выборе лечебной тактики и объема консервативного лечения у больных с ХОЗАНК необходимо определить стадию хронической ишемии нижних конечностей, характер поражения, тяжесть сопутствующей патологии, выявление факторов риска, оценки мотивации самого пациента на хороший результат. Проведение комплексного обследования (клинического, лабораторного, инструментального) перед началом лечения, в том числе и консервативного, является обязательным.
Анализируя наш многолетний опыт и опыт наших коллег, мы заключили, что в большинстве случаев назначения были непонятны больным, особенно когда врачи одновременно назначали сразу несколько препаратов. Для того чтобы избежать этого, мы несколько лет назад разработали схему лечения – простую и информативную (таб. 2,3- как пример).
Преимущество этих схем и такого подхода сводятся к следующему:
- в схеме лечения можно изложить названия всех рекомендуемых препаратов в любых сочетаниях;
- в ходе беседы с больным, во время которой врач объясняет суть заболевания, способы его выявления, признаки обострения, подтверждая свои слова наглядной информацией, содержащейся в листе назначений, облегчается восприятие пациентами рекомендаций врача (высокий уровень комплаентности);
- облегчается восприятие информации, полученной, в том числе, и от других врачей;
- в максимальной степени обеспечивается взаимосвязь между врачом и пациентом.
Использование предлагаемой схемы лечения достаточно просто и не требует временных и материальных затрат.
Отдельно мы выявляем факторы риска и принимаем меры по их возможной коррекции (пожилой возраст, недостаточные физические нагрузки, курение, сахарный диабет и др.). При таком подходе практически всеми больными наши рекомендации выполняются полностью.
Принципы консервативного лечения больных ХОЗАНК, несмотря на достигнутые успехи в фармакологии, до сих пор разработаны в недостаточной степени и не полностью включают патофизиологически обоснованные направления лечебной программы.
Мы предлагаем следующие направления комплексной консервативной терапии ХОЗАНК:
- антитромбоцитарная, антикоагулянтная терапия;
- липидокорригирующая терапия;
- терапия нарушений микро- и макроциркуляции;
- терапия метаболических расстройств;
- интенсивная противовоспалительная терапия, в том числе специфическая пульс-терапия.
- стимуляция ангиогенеза (введение препарата неоваскулгена, тренировочная ходьба, операции непрямой реваскуляризации – миниинвазивная лапароскопическая поясничная и торакоскопическая грудная симпатэктомии);
- комбинированная и сочетанная терапия сопутствующей патологии.
Вышеуказанные направления консервативной терапии ХОЗАНК обязательно должны учитываться при составлении индивидуальной программы лечения.
При I и IIА стадиях хронической ишемии конечностей обычно назначаемя комплекс консервативных мероприятий (или комплексное консервативное лечение+оперативные вмешательства непрямой реваскуляризации конечности- поясничная и грудная симпатэктомия), при более поздних стадиях проводим комплекс терапевтических мероприятий и реконструктивные артериальные операции, а на IV стадии может встать вопрос об ампутации (малой или большой).
Показания и противопоказания
Показания
- Облитерирующие заболевания артерий нижних конечностей I-IIА,Б стадии, в том числе после ранее перенесенных оперативных вмешательств.
- Облитерирующие заболевания артерий нижних конечностей III-IV садии, в том числе после ранее перенесенных оперативных вмешательств с рецидивом ишемии.
- Облитерирующие заболевания артерий нижних конечностей III-IVа стадии, когда реконструктивные операции выполнить невозможно, или имеются противопоказания к их выполнению, или пациент отказывается от их выполнения.
- Профилактика артериальных и венозных тромботических осложнений
Противопоказания
Противопоказаний к консервативному лечению нет.
Преимущества фотодинамической терапии
- Операция относится к органосохраняющим, внешний вид молочной железы после хирургического вмешательства сохранен.
- Операцию можно провести под контролем УЗИ, что дает возможность максимально точно локализовать очаг патологии.
- Удалению подлежит только пораженный болезнью участок, здоровые ткани не затрагиваются.
- Безопасна и отличается быстрым заживлением раневой поверхности и восстановлением пациента после операции.
Преимущества тактических особенностей комплексного консервативного лечения ХОЗАНК, разработанные и принятые в нашей клинике, используемые нами в течение 5-10 лет, позволяют:
- достичь стойкой ремиссии ишемии нижних конечностей у большинства пациентов и в большинстве случаев отказаться от выполнения реконструктивных операций на артериях, чреватых часто тяжелыми осложнениями;
- значительно уменьшить проявления основного заболевания и сопутствующей патологии, улучшить их прогноз;
- значительно уменьшить, а в подавляющем большинстве случаев избежать риска развития тромботических осложнений в ближайшем и отдаленном периода наблюдения, в том числе после реконструктивных операций на артериях;
- значительно повысить качество жизни наших пациентов;
- проводить комплексную терапия амбулаторно в подавляющем большинстве случаев.
Комментарий врача
У Вас облитерирующее заболевание артерий нижних конечностей, и Вы не знаете, где провести обследование и комплексную адекватную терапию согласно тяжести вашего заболевания? В нашей клинике используются самые современные методики диагностики и лечения, в том числе оригинальные. Мы противники единого шаблона для лечения пациентов с облитерирующими заболеваниями артерий нижних конечностей. Для каждого пациента мы подбираем комплекс методик консервативного лечения, основываясь на индивидуальных особенностях течения заболевания, наличия и тяжести сопутствующей патологии, физической и социальной активности, отношения к своему заболеванию, мотивации на хороший отдаленный результат. Запишитесь на консультацию к сосудистому хирургу и Вы узнаете все о характере, прогнозе Вашей болезни. Мы вместе с Вами составим не только подробный план обследования для выявления факторов риска к комплексному лечению, но и определим оптимальный для Вас комплекс методик консервативного лечения, позволяющий минимизировать риск возможных осложнений и побочного действия лекарственных препаратов, добиться хорошего результата. Мы опираемся на наш многолетний опыт, принципы преемственности в лечении и семейной медицины, принципа «открытых дверей», когда больной имеет право обратиться к лечащему врачу по необходимости в любое время. Мы определим периодичность дальнейших контрольных осмотров и проведения профилактических курсов лечения для своевременной профилактики и устранения рецидива ишемии, коррекции базового консервативного лечения. Учитывая хронический, постоянно прогрессирующий и многопричинный характер ОЗАНК, принцип «пролечил и забыл» следует считать пагубным. Мы вместе с Вами постараемся не только избавить Вас от тяжелых проявлений болезни и ее возможного рецидива, но и значительно повысить качество Вашей жизни в дальнейшем.
Руководитель центра сосудистой хирургии Гирсиашвили Алеко Гивиевич
Почему комплексное консервативное лечение облитерирующих заболеваний артерий нижних конечностей лучше провести в Швейцарской Университетской клинике?
- Перед началом лечения проводится комплексное обследование пациента с целью определения характера и тяжести основного заболевания и сопутствующей патологии. Мы работаем по принципу «не навреди».
- В нашем Центре сосудистой хирургии и флебологии комплексное консервативное лечение проводится по авторским методикам, благодаря которым удалось добиться клинического улучшения и стойкой ремиссии заболевания.
- Мы одними из первых в стране начали применять инновационный препарат (неоваскулген- камбиогенплазмид) и миниинвазивные малотравматичные оперативные вмешательства непрямой реваскуляризации конечностей (лапароскопическая поясничная и торакоскопическая грудная симпатэктомии) для развития собственных артерий на конечностях и уменьшения ишемии у больных, которым выполнить реконструкцию артерий не представляется возможным, пациент отказывается от нее или имеются противопоказания к ее выполнению.
- Мы придерживаемся тактики своевременного комплексного и комбинированного лечения, направленного на развитие собственных артерий (ангиогенеза) на конечностях. В подавляющем большинстве случаев это позволяет нам отказаться от выполнения реконструктивных операций на артериях, чреватых часто тяжелыми осложнениями.
- Мы широко используем методики консервативного лечения для предотвращения артериальных тромботических осложнений, в том числе после реконструктивных операций на аорте и артериях различных бассейна, а также пульс-терапию при облитерирующем эндартериите конечностей и аорто-артериите. Лечение проводится под постоянным контролем высококвалифицированного сестринского и врачебного персонала.
- Сосудистые хирурги нашей клиники имеют многолетний опыт проведения консервативного лечения, каждый из наших специалистов в совершенстве владеет всеми используемыми в нашей клинике методиками. Все врачи сертифицированные специалисты высшей квалификационной категории с учеными степенями.
- Ультразвуковая диагностика заболеваний магистральных артерий проводится самими сосудистыми хирургами на оборудовании экспертного класса на самом высоком профессиональном уровне. Нами разработан и внедрен в практику протокол УЗИ магистральных артерий, позволяющий улучшить качество обследования.
- Центр сосудистой хирургии имеет все необходимые оригинальные лекарственные препараты для проведения качественного лечения.
- Мы проводим консервативное лечение в соответствии с международными стандартами, качество оказанных услуг оценивается международными организациями, которые регулярно посещают нашу клинику с целью проверки соблюдения международных стандартов.
- Для каждого пациента мы подбираем комплекс методик консервативного лечения, основываясь на индивидуальных особенностях течения заболевания, наличия и тяжести сопутствующей патологии, физической и социальной активности, отношения к своему заболеванию, мотивации на хороший отдаленный результат.
- Мы строго и неуклонно придерживаемся принципов преемственности в лечении и семейной медицины, принципа «открытых дверей», когда больной имеет право обратиться к лечащему врачу по необходимости в любое время.
- Мы определим периодичность дальнейших контрольных осмотров и обследований для своевременного выявления признаков прогрессирования заболевания и коррекции консервативного лечения.
- Мы вместе с Вами постараемся не только уменьшить проявления болезни и возможность их рецидива, но и значительно повысить качество Вашей жизни в дальнейшем.
Часто задаваемые вопросы
- Для того, чтобы начать лечение, прежде всего обязательно нужно пройти обследование у врача- ангиохирурга. Цель обследования- не только установить диагноз основного заболевания, вызывающего ишемию конечности, но и оценить характер и тяжесть сопутствующей патологии, выявить факторы риска и противопоказания к планируемому лечению. Должен работать принцип «не навреди». Объем обследования первоначально обязательно должен включать: осмотр сосудистого хирурга, УЗИ арты и магистральных сосудов, общий анализ крови и мочи, биохимический анализ крови, коагулограмму, ЭКГ, флюорографию органов грудной клетки, осмотр терапевта (кардиолога). Далее, учитывая распространенный характер поражения атеросклерозом и тяжесть сопутствующей патологии, объем обследования может быть расширен, привлечены к проведению обследования другие специалисты.
- Комплексное консервативное лечение в большинстве случаев проводится амбулаторно в условиях дневного стационара. За 3-4 часа нахождения в стационаре проводится весь комплекс консервативного лечения.
- Побочное действие или осложнение возможны при введении любого лекарства. Однако в нашей клинике риск подобных осложнений практически исключен. Во-первых, мы строго подходим к выбору объема и характера лечения, учитывая тяжесть основного заболевания и сопутствующей патологии. Во-вторых, лечение проводится под постоянным контролем высококвалифицированного сестринского и врачебного персонала. В третьих, после убывания домой пациенты находятся на телефонной связи с лечащим врачом.
- За последние несколько лет в арсенал лекарственных средств сосудистого хирурга вошел препарат неоваскулген (камбиогенплазмид), предназначенный для стимуляции роста собственных артерий (ангиогенеза). Препарат создан в качестве лечебного средства для уменьшения тяжести ишемии, снижения частоты ампутации и смертности больных с хронической ишемией конечности, в особенности у пациентов, которым не может быть проведена стандартная сосудистая реконструкция по тем или иным причинам. После обработки кожи антисептиком Неоваскулген вводят внутримышечно в дозировке 1,2 мг дважды с интервалом в 14 дней в место, близкое к ишемизированному участку. Вводят препарат дробно несколькими уколами с максимально возможной инфильтрацией раствором всего массива мышц пораженного участка. Лиофилизат растворяют в 1,2 мл воды для инъекций. Препарат должен полностью раствориться. Раствор перед введением должен быть комнатной температуры. Введение препарата осуществляется в стационаре или в амбулаторных условиях под наблюдением врачей. К сожалению, препарат имеет высокую стоимость и в настоящее время широко не распространен. Препарат с 2015 года включен в Национальные рекомендации по лечению облитерирующих заболеваний конечностей. Мы имеем опыт лечения данным препаратом 32 пациентов. Отдаленные результаты расценены нами как хорошие. Осложнений при использовании данного препарата мы не отметили.
- ХОЗАНК являются неизлечимыми хроническими заболеваниями, но при соблюдении регулярных курсов консервативного лечения возможно избежать такого грозного осложнения как гангрена и значительно улучшить качество жизни. У ряда пациентов требуется непрерывный прием лекарственных препаратов. Курсы консервативной инфузионной терапии, при отсутствии противопоказаний, следует проводить 2 раза в год, желательно весной и осенью.
Сердечно-сосудистые заболевания и эректильная дисфункция
Термин «эректильная дисфункция» предложен Национальным Институтом здравоохранения США вместо «импотенции». В 1992 году его приняли международные организации урологов и андрологов.
В широком смысле эректильная дисфункция включает в себя не только неспособность удерживать половой член в состоянии эрекции, но и нарушения оргазма, а также ослабление либидо — полового влечения.
В связи увеличением продолжительности жизни и формированием социально активного стереотипа поведения даже в пожилом возрасте эректильная дисфункция (ЭД) у мужчин приобретает важное значение, а эрекция воспринимается как символ власти, символ мужского достоинства.
Важное значение ЭД имеет и для врача, поскольку эрекция является сосудистой реакцией и ее нарушения бывают отражением наличия у пациента сердечно-сосудистой патологии.
Согласно данным Согласительной комиссии Национального института здравоохранения США, эректильной дисфункцией страдает не менее 30 млн мужчин в этой стране (Nffl Consensus Develohincnt Panel on Impotence/. Amer. Med. Assoc. – 1993. Vol. 270, .№ 1.- P. 83-90). В Массачусетском исследовании но изучению вопросов старения мужчин (Feldman Н.Л. at al., 1994).
проводился опрос 1709 мужчин в возрасте от 40 до 70 лет. Результаты исследования продемонстрировали следующие закономерности: эректильная дисфункция отмечалась у 39% лиц в возрасте 40 лет, наблюдалось у 48% мужчин в возрасте 50 лет, у 60-летних эректильная дисфункция встречалась у 57%, а у 70-летних граждан – в 67% случаев.
Таким образом, тенденция к прогрессированию эректильной дисфункции усиливалась с нарастанием продолжительности жизни наблюдаемых, т. е. увеличивалась с каждым новым десятилетием.
Увеличение продолжительности жизни и формированиее социально активного стереотипа поведения даже в пожилом возрасте приводит к тому, что эректильная дисфункция (ЭД) у мужчин приобретает важное значение, а эрекция воспринимается как символ состоятельности, здоровья, символ мужского достоинства.
Результаты специальных проспективных наблюдений (Duke longitudinal study, Swedish study, Caerphilly cohort study) свидетельствуют о том, что у мужчин с относительно низкой частотой половых актов и оргазмов, а также у рано утративших сексуальную активность повышен риск смерти.
Возникновение ЭД дисфункции у пациента имеет важное значение и для врача, поскольку эрекция является сосудистой реакцией и ее нарушения бывают отражением наличия у пациента сердечно-сосудистой патологии. Когда-то предполагалось, что в большинстве случаев ЭД имеет психогенную природу.
Но исследования, прояснившие истинный механизм возникновения эрекции, показали, что у пациентов после 40 лет ЭД в 80% случаев возникает, как осложнение различных соматических заболеваний (Щеплев П.А. и соавт., 2002).
Наличие тесной корреляции с микро- и макроангиопатиями — безусловное доказательство того, что ЭД является облигатным фактором риска кардиоваскулярных заболеваний. Наличие эректильной дисфункции часто ассоциируется с одним или несколькими сердечно–сосудистыми заболеваниями (артериальной гипертензией, атеросклерозом) и сахарным диабетом (Feldman H.A. et al., 1994).
Поражение сосудов полового члена препятствует возникновению эрекции, необходимой для выполнения полового акта.
По мнению некоторых авторов, выявление ЭД может свидетельствовать о наличии у пациента латентной формы СД, АГ и ишемической болезни сердца (ИБС), что позволяет рассматривать явную ЭД как вероятный предиктор скрыто протекающего сосудистого поражения сердца и артериальной гипертензии так как диаметр артерий, кровоснабжающих половой член на много меньше диаметра коронарных артерий и поэтому ЭД может служить ранним предвестником сердечно-сосудистых заболеваний, а по степени ее тяжести можно судить о прогрессировании ИБС.
При атеросклерозе стенки сосудов утрачивают эластичность и сужаются за счет атеросклеротических бляшек, что приводит к развитию инфарктов и инсультов. Вследствие атеросклеротического поражения сосудов возникает не только механическое нарушение кровотока, но и нарушается выработка нейромедиаторов, уменьшается эластичность сосудов.
Дисфункция эндотелия и недостаточная продукция им оксида азота являются важнейшим патогенетическим звеном как АГ так и васкулогенной ЭД. Развивающееся ремоделирование со снижением эластичности и уменьшением просвета кровеносных сосудов, обеспечивающих кровоток во время эрекции, приводит к развитию васкулогенной ЭД.
Нередко различные проявления атеросклероза (ИБС и эректильная дисфункция) развиваются параллельно, поскольку факторы риска эндотелиальнойдисфункции и атеросклероза, поражающего пенильные кровеносные сосуды те же, что и факторы риска ИБС – курение, дислипилемия, сахарный диабет.
Риск ИБС у пациентов в возрасте старше 50 лет достоверно повышен при наличии эректильной дисфункции (Speei et al.,2003).
Артериальная гипертония так же способствует возникновению эректильной дисфункции, даже в отсутствие атеросклероза.
Международные экспериментальные исследования по изучению артериальной гипертонии и эректильной дисфункции показали, что АГ способствует пролиферации мышечной ткани в кавернозных телах и кровеносных сосудах, вызывает фиброз кавернозной ткани и увеличивает в ней количество коллагена типа III.При этом выраженность этих изменений прямо пропорциональна степени повышения систолического АД.
Прием лекарственных средств, неадекватная гипотензивная терапия может быть причиной эректильной дисфункции в 25% случаев по данным (O”Keefe et al., 1995).
Клиническими признаками медикаментозной эректильной дисфункции считают относительно быстрое начало, временную связь с приемом препарата отрицательно влияющего на различные звенья полового акта, уменьшение выраженности расстройства или полное его исчезновение после отмены препарата.
Очень часто возникновение эректильной дисфункции связывают с приемом гипотензивных средств, особенно тиазидных диуретиков и в-блокаторов, особенно первых поколений.
Предполагается, что эректильная дисфункция может возникать вследствие уменьшения притока крови к половому члену, однако неясно, является ли это уменьшение следствием снижения системного АД при эффективной гипотензивной терапии, результатом сосудистого заболевания или проявлением каких-либо других неизвестных эффектов лекарственного средства.
Если бы снижение АД само по себе способствовало развитию эректльной дисфункции, то она развивалась бы на фоне любой гипотензивной терапии. Доказано, однако, что многие гипотензивные средства не вызывают эректильную дисфункцию.
Применение блокаторов ангиотензиновых рецепторов достоверно уменьшает изменения кавернозной ткани, отмечена даже тенденция к повышению сексуальной активности мужчин и статистически достоверное увеличение половой удовлетворенности. Считается так же что антагонисты кальция не ухудшают мужскую половую функцию. Во многих случаях изменение режима приема препаратов может помочь больному преодолеть негативные изменения в сексуальной сфере, наблюдающиеся при некоторых видах лечения. Целесообразно выбирать такое гипотензивное лечение, которое не только снижало бы АД, но и сохраняло бы качество жизни.
Практический врач должен помнить о возможности влияния гипотензивной терапии на половую сферу мужчин и обсуждать эту тему со своими пациентами.
Не только среди пациентов но и среди врачей широко распространено мнение о высоком риске внезапной смерти больных сердечно-сосудисиыми заболеваниями во время полового акта, однако, как показывает ряд проведенных исследований, эти страхи значительно преувеличены.
Физическая нагрузка во время сексуальной активности не так уж велика – в среднем она сходна с прогулкой на 1,6км за 20 мин или подъемом на 2 пролета лестницы (20 ступеней) за 10 сек. Во время полового акта максимальная частота сердечных сокращений (ЧСС) мужчины в среднем достигает 120–130 уд./мин, при этом систолическое артериальное давление (САД) повышается до 150–180 мм рт.
ст. Однако эти показатели имеют место в течение лишь 3–5 минут при средней длительности полового акта 5–15 минут. В исследовании J.E. Muller и соавт. (1996) было установлено, что относительный риск развития ИМ во время полового акта и в последующие 2 часа в 2,5 раза, а у больных, ранее перенесших ИМ, почти в 3 раза выше, чем во время иной активности .
Расчеты этих исследователей показывают, что у практически здорового (без явной ишемической болезни сердца (ИБС)) 50-летнего мужчины вероятность развития ИМ во время полового акта составляет 1 % на протяжении года, или 1 шанс из миллиона на протяжении часа.
Если такой мужчина выполняет половой акт один раз в неделю, то риск развития ИМ во время акта или в последующие 2 часа увеличивается всего до 1,01 % за год (2–3 шанса на миллион в час).
Однако у мужчины того же возраста, столь же активного в сексуальном отношении, но уже перенесшего ИМ, исходная величина риска развития повторного ИМ составляет примерно 10 % за год, а во время половой активности и в последующие 2 часа риск возрастает до 10,1 %, т.е. он увеличивается с 10 до 20–30 шансов на миллион в час.
По другим данным, риск возникновения ИМ после сексуальной активности у пациента с изолированным сердечно-сосудистым заболеванием (ССЗ) повышается до ~ 30 случаев на миллион/час в течение 2 часов после коитуса. В одном 25 летнем исследовании, проведённом в США, включавшем 270 мужчин и женщин в возрасте 60-94 лет (в среднем 70) на момент начала исследования, было выяснено, что частота половых актов коррелируют с продолжительностью жизни мужчин. В то же время, шведское исследование, включавшее 128 женатых мужчин в возрасте 70 лет, за которыми проводилось наблюдение в течение 5 лет, показало, что раннее прекращение сексуальной жизни (ранее 70 лет) сопровождается с повышенным риском смерти по сравнению с группой продолжающей сексуальную жизнь.
Таким образом можно констатировать, что сексуальная жизнь должна быть и является важным компонентом качественной жизни больных с сердечно-сосудистыми заболеваниями. Соблюдение мультидисциплинарного подхода в ведении данной категории больных является залогом эффективного лечения пациентов с сердечно- сосудистой патологией с сохранением высокого качества жизни.
Окклюзионная болезнь периферических артерий: что мы можем сделать для пациента уже сегодня? | Фармацевтическая корпорация «Юрія-Фарм»
Национальный медицинский университет имени А.А. Богомольца, г. Киев
Окклюзионная болезнь периферических артерий нижних конечностей (ОБПА; облитерирующий атеросклероз артерий нижних конечностей) является важным и очень распространенным проявлением системного атеросклероза, которое приводит к существенному ограничению способности больных к передвижению, снижению качества их жизни и ассоциируется с высоким риском сердечно-сосудистой заболеваемости и смертности [1]. Следует отметить, что согласно современному определению, приведенному в практическом руководстве Американской коллегии кардиологов (ACC) и Американской ассоциации сердца (AHA) (2005), под термином ОБПА понимают атеросклеротическое поражение не только артерий нижних конечностей, но и других периферических сосудов, в частности артерий, кровоснабжающих внутренние органы (за исключением коронарных артерий) и головной мозг [2]. Распространенность ОБПА повышается с возрастом, и у лиц старших возрастных групп без сопутствующей эндокринной патологии, по данным отдельных эпидемиологических исследований, колеблется в достаточно широких пределах (от 2,5% в группе лиц в возрасте моложе 65 лет до 18,8% в группе лиц в возрасте старше 70 лет), составляя в среднем около 12% [1, 3, 4, 8]. Прогноз у па-циентов с ОБПА нижних конечностей в целом неблагоприятен: среди пациентов с перемежающейся хромотой (ПХ) уровень смертности составляет 3–5% в год, среди больных с критической ишемией нижних конечностей — более 20% в год [13].
Как установить диагноз ОБПА, или как часто вы измеряете пациентам АД на ногах?
К сожалению, в условиях реальной клинической практики все еще отмечается гиподиагностика ОБПА. Казалось бы, настороженность практикующих врачей относительно кардио- и цереброваскулярной патологии, в основе которой лежит атеросклероз (ишемическая болезнь сердца (ИБС), инфаркт миокарда, ишемический инсульт), и так достаточно высока.
Действия специалистов здравоохранения, направленные на ее профилактику, своевременную диагностику, адекватное лечение и реабилитацию пациентов, уже увенчались значительным успехом, особенно в развитых странах.
Удивительно, но ОБПА, в основе развития которой лежит тот же системный атеросклеротический процесс, пока, к сожалению, не стала предметом столь пристального внимания практикующих врачей первичного звена здравоохранения.
Вместе с тем ее медико-социальная значимость никак не меньше — это коварное заболевание, многие годы протекающее субклинически, как само по себе существенно снижает качество жизни больных и характеризуется высокими показателями инвалидизации и смертности, так и является очень точным «маркером» высокого риска основных кардио- и цереброваскулярных событий (фатального и нефатального инфаркта миокарда, ишемического инсульта). Характерно, что относительный риск сердечно-сосудистой смерти при ОБПА не зависит от наличия у пациентов проявлений коронарной или цереброваскулярной недостаточности [9, 10]; тяжесть ОБПА тесно коррелирует с риском острого инфаркта миокарда, ишемического инсульта и сосудистой смерти [2, 11].
Между тем диагностика ОБПА не представляет существенных трудностей и фактически доступна любому врачу! Важнейшим критерием установления диагноза ОБПА и показателем выраженности этого заболевания является так называемый лодыжечно-плечевой индекс (ЛПИ, ankle-brachial index — ABI) — соотношение систолического артериального давления (САД), определенного на лодыжке (на a. dor-salis pedis и задней большеберцовой артерии), и САД на руке (на плечевой артерии). Для определения ЛПИ врач может использовать как обычный аппарат для измерения АД, так и аппарат УЗИ. Важно помнить, что измерение САД на обеих ногах и оценку ЛПИ следует проводить после 10-минутного отдыха пациента в положении лежа. В норме ЛПИ составляет 0,91–1,30; клинический диагноз ОБПА нижних конечностей может быть установлен при снижении этого показателя < 0,9. При снижении ЛПИ < 0,4 у пациента констатируют наличие тяжелой ОБПА нижних конечностей. В ряде случаев ЛПИ при ОБПА находится в пределах нормы, но после физической нагрузки снижается на 20% и более. Чем ниже ЛПИ, тем выше риск угрожающих жизни сердечно-сосудистых и цереброваскулярных исходов. Смертность среди пациентов с тяжелой ишемией нижних конечностей, по данным некоторых авторов, достигает 25% в год [5]. О важности рутинной оценки ЛПИ и выявления асимптомного течения ОБПА у всех пациентов с высоким кардио- и цереброваскулярным риском свидетельствуют и результаты последних клинических исследований, выполненных в соответствии с принципами доказательной медицины. Так, в ходе клинического исследования с участием 747 пациентов с диагнозом ишемического инсульта или транзиторной ишемической атаки (ТИА), результаты которого стали доступны онлайн в январе этого года [12], было показано, что снижение ЛПИ < 0,9 отмечается у 18,1% таких больных и достоверно коррелирует с возрастом старше 60 лет (р < 0,0001), а также с анамнезом предшествующих ишемических событий, включая ИБС (р = 0,001), атеросклеротическое поражение сосудов головного мозга (р = 0,002) и фибрилляцию предсердий (р = 0,036). Авторы этого исследования делают вывод, что ЛПИ целесообразно определять у всех пациентов с ишемическим инсультом, так как это поможет не только своевременно диагностировать ОБПА, но и выделить группу больных, подверженных особенно высокому риску повторного острого нарушения мозгового кровообращения и других сосудистых осложнений.
Наиболее важным клиническим проявлением ОБПА нижних конечностей является ПХ, отмечающаяся приблизительно у каждого третьего пациента с этой формой атеросклероза.
ПХ характеризуется болями в одной или обеих ногах при ходьбе, которые могут значительно ограничивать способность пациента к передвижению, но обычно значительно ослабевают в покое. Кроме того, при ОБПА нередко наблюдаются судороги и выраженная слабость в ногах, также провоцируемые ходьбой.
Как правило, ПХ развивается достаточно медленно. Ее тяжелая форма с выраженной ишемией нижних конечностей (резкие боли в состоянии покоя, трофические язвы, гангрена) отмечается всего в 5–10% случаев, но ассоциируется с очень высоким риском потери ноги. Однако более чем у половины пациентов с ОБПА типичная ПХ не выявляется.
Заболевание проявляется у них только уменьшением ЛПИ (0,41–0,90), быстрой утомляемостью при ходьбе, тяжестью в нижних конечностях и снижением качества жизни. Таким образом, в большинстве случаев ОБПА проявляется в основном функциональными нарушениями, ведущими к ограничению подвижности пациентов [1].
Показано, что симптоматические формы ОБПА являются лишь «вершиной айсберга»: количество пациентов с бессимптомным течением заболевания, диагностированного с помощью неинвазивных методов, в 3–4 раза превышает количество тех, у кого отмечается ПХ [13].
В фокусе особого внимания — пациенты высокого риска
Согласно современным представлениям к главным факторам риска развития ОБПА относят возраст старше 40 лет, мужской пол, табакокурение и сахарный диабет (СД).
По данным масштабного многоцентрового исследования PARTNERS [6] участие в котором в целом приняли 6979 пациентов, среди лиц в возрасте старше 70 лет, а также в группе лиц в возрасте 50–69 лет, которые курят или больны СД, распространенность ОБПА (оценивалась амбулаторно посредством определения ЛПИ) достигает 29% — то есть данную патологию отмечают практически у каждого третьего.
Наличие СД достоверно повышает час-тоту ОБПА — если среди лиц с нормальной толерантностью к глюкозе распространенность ОБПА составляет 12,5% случаев, то при ее нарушении и СД она достигает 19,9 и 22,4% соответственно [7].
Другими важными факторами риска развития ОБПА являются гиперлипидемия, артериальная гипертензия (АГ), гипергомоцистеинемия и повышение уровня С-реактивного белка (СРБ) в плазме крови [2].
Характерный профиль этих факторов, системность атеросклеротических поражений в сочетании с вы-соким риском ишемических сосудистых катастроф служат основанием для проведения при ОБПА мероприятий по вторичной профилактике атеротромботических осложнений, включая агрессивную гиполипидемическую терапию, лечение СД и АГ, назначение антитромбоцитарных средств. К сожалению, до сих пор вторичную профилактику при ОБПА, в частности, гиполипидемическую и антитромбоцитарную терапию, проводят значительно реже, чем, например, при ИБС, хотя ее необходимость при данном заболевании ничуть не меньше [1].
- Согласно рекомендациям АСС/АНА (2005) детальное клиническое обследование нижних конечностей с определением пульсации периферических артерий и оценкой ЛПИ в обязательном порядке следует проводить всем лицам с высоким риском развития ОБПА. К ним относятся [2]:
- • пациенты в возрасте моложе 50 лет с СД или другими факторами риска развития атеросклероза (курение, дислипидемия, АГ и гипергомоцистеинемия);
- • лица в возрасте 50–69 лет, имеющие анамнестические данные о табакокурении и наличии СД;
- • лица в возрасте 70 лет и старше;
- • пациенты с наличием характерной клинической симптоматики со стороны нижних конечностей, возникающей при физической нагрузке (ПХ) или болевого синдрома ишемического характера, возникающего в состояние покоя;
- • пациенты с отклонениями от нормы показателей пульсации артерий нижних конечностей, выявленными при физикальном обследовании;
- • пациенты, которым уже установлен диагноз атеросклеротического поражения коронарных, сонных или почечных артерий.
Пациентам, у которых отмечена характерная для ОБПА нижних конечностей клиническая картина или выявлено снижение ЛПИ < 0,9, показано проведение дополнительного инструментального обследования — в первую очередь, ультразвуковой допплерографии и стандартного тредмил-теста.
В качестве неинвазивных методов исследования также может быть использовано ультразвуковое ангиосканирование, благодаря которому можно с большей достоверностью определить степень стенотического поражения.
В последнее время в диагностике ОБПА все шире применяют дуплексное ультразвуковое ангиосканирование, характеризующееся неинвазивностью, безопасностью для пациента, а также высокой чувствительностью и специфичностью.
По данным этого метода определяется не только структура атеросклеротической бляшки, но и оценивается гемодинамическая степень стеноза, что имеет принципиальное значение.
Рентгеноконтрастное ангиографическое исследование в настоящее время является основным методом диагностики облитерирующих заболеваний сосудистого русла.
С его помощью можно точно определить локализацию, протяженность, степень и характер стеноза, множественность окклюзионных поражений магистральных артерий нижних конечностей, оценить состояние коллатерального русла, прогнозировать характер и объем реконструктивной операции, а также осуществлять контроль за эффективностью лечения и хирур-гического вмешательства. Ангиологи и сосудистые -хирургы используют также такие методы диагностики, как лазерная допплер-флоуметрия, транс-кутанное мониторирование О2, фотоплетизмография, радиоизотопное исследование, компьютерная томография и ядерно-магнитный резонанс [14].
Прогрессирование и исходы заболевания, или что же ждет пациента с ОБПА без лечения?
Как уже было отмечено, для пациентов с ОБПА характерен очень высокий риск кардиоваскулярных ишемических событий, поскольку атеросклероз является системным, мультифокальным патологическим процессом, и у подавляющего большинства таких больных наряду с поражением периферических ар-терий выявляют и атеросклеротическое поражение коронарных и церебральных артерий. При этом у пациентов с ОБПА нижних конечностей кардиоваскулярные события развиваются достоверно чаще, чем ишемические осложнения со стороны собственно артерий нижних конечностей [15] (рисунок). При клиническом обследовании в сочетании с регистрацией ЭКГ ИБС диагностируют у 40–60% пациентов с ОБПА, а при коронарографии — у 90% больных [13].
Цереброваскулярные заболевания также очень часто диагностируют у пациентов с ОБПА в качестве сочетанной патологии. Так, у 12–25% пациентов с ОБПА нижних конечностей при проведении дуплексной ультрасонографии выявляют гемодинамически значимые стенозы сонных артерий [16–18].
При этом, как было показано в одном из исследований, приблизительно у 30% пациентов с выраженным стенозом сонных артерий отмечают симптомы ишемии мозга [17]. Установлено, что тяжесть ОБПА коррелирует с выраженностью и протяженностью стеноза сонных артерий [19].
Таким образом, всем врачам, занимающимся ведением пациентов с ОБПА нижних конечностей, следует проявлять особую настороженность в отношении частого наличия у таких больных в качестве сопутствующей патологии ИБС и церебро-васкулярных заболеваний.
Вследствие сосуществования указанных патологий у пациентов с ОБПА нижних конечностей отмечается и значительно повышенный риск кардио- и цереброваскулярных осложнений: ИМ, инсульта и смерти вследствие сердечно-сосудистых причин.
Риск ИМ у пациентов с ОБПА нижних конечностей повышается на 20–60%, а риск смерти от любых осложнений ИБС — в 2–6 раза. Риск инсульта при наличии ОБПА нижних конечностей повышается примерно на 40%; при этом степень тяжести ОБПА коррелирует с частотой ТИА и инсультов [2].
Современные подходы к консервативной терапии пациентов с ОБПА
Согласно руководству АСС/АНА (2005) по ведению пациентов с ОБПА, одной из главных целей лечения пациентов с ОБПА нижних конечностей должно быть снижение риска кардиоваскулярных событий.
У этих больных консервативное лечение следует проводить пожизненно, и оно должно включать воздействие на все модифицируемые факторы риска прогрессирования атеросклероза: отказ от табакокурения, соблюдение гиполипидемической диеты и медикаментозную коррекцию дислипидемии, контроль гликемии при нарушении толерантности к глюкозе и СД, достижение целевых уровней АД, регулярное выполнение физических упражнений. Вторичная профилактика ишемических осложнений у пациентов с ОБПА подразумевает агрессивную гиполипидемическую терапию статинами (уровень доказательности В) и назначение антитромбоцитарных препаратов (уровень доказатель-ности А), однако значение такого рода превентивных мероприятий у пациентов с ОБПА, к сожалению, в ре-альной клинической практике зачастую недооценивается, хотя при этом заболевании они показаны не в меньшей степени, чем при ИБС [1, 2]. С целью снижения риска ИМ, инсульта, застойной сердечной недоста-точности и кардиоваскулярной смертности всем пациентам с ОБПА нижних конечностей и АГ показана антигипертензивная терапия, которая предполагает достижение целевого уровня АД < 140/90 мм рт. ст. у больных без СД и

 При поступлении пациент предъявлял жалобы на одышку в положении сидя, слабость. При осмотре врачом приемного отделения определено ясное сознание и моторная афазия. АД ‒ 118/70 мм рт. ст., частота сокращений сердца (ЧСС) – 62 уд/мин, при аускультации тоны сердца ритмичные, в нижних отделах легких мелкопузырчатые влажные хрипы, слева ослабление везикулярного дыхания, частота дыхания (ЧД) – 21 в минуту. Представлены результаты обследования пациента.
При поступлении пациент предъявлял жалобы на одышку в положении сидя, слабость. При осмотре врачом приемного отделения определено ясное сознание и моторная афазия. АД ‒ 118/70 мм рт. ст., частота сокращений сердца (ЧСС) – 62 уд/мин, при аускультации тоны сердца ритмичные, в нижних отделах легких мелкопузырчатые влажные хрипы, слева ослабление везикулярного дыхания, частота дыхания (ЧД) – 21 в минуту. Представлены результаты обследования пациента.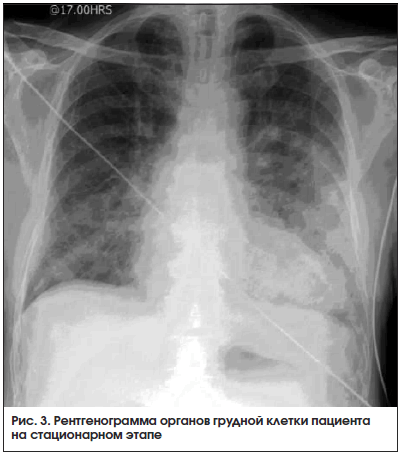 Диагноз, выставленный при поступлении пациента в стационар
Диагноз, выставленный при поступлении пациента в стационар