Главная » Эхокардиография » 2020 » Декабрь » 26 » Эхокардиография митрального клапана (часть 3)
| Кальциноз митрального кольца – обычно заболевание пожилых людей, преимущественно женщин. На эхокардиографии он также присутствует при других состояниях, таких как гипертония и / или стеноз аорты. Кальцификация поражает сердце либо однородно, либо неоднородно. Обычно он затрагивает митральное кольцо, но может распространяться на базальную зону перегородки, корень аорты и створки или, в редких случаях, на всю базальную область желудочка. Однако, если кальцификация захватывает базальную часть митральных створок, это может привести к увеличению скорости наполнения и может быть связано с легкой митральной регургитацией, но чаще всего нарушения проводимости возникают примерно у 50% пациентов. При поражении митрального кольца обычно сохраняются сами створки, и клапан не становится стенозированным. Было показано, что комбинация кальцификации митрального кольца и кальцификации аорты на эхокардиографии также предсказывает кальцификацию коронарной артерии. Ведение: при отсутствии значительного митрального стеноза протезирование клапана не показано. При поражении корня аорты и створок, приводящих к стенозу, замена аортального клапана и корня аорты обычно успешна. Кальцификация митрального кольца не является поверхностной, а проникает глубоко в миокард. Во время операции декальцинация митрального кольца для замены клапана может привести к перфорации миокарда. Следовательно, замена митрального клапана никогда не должна выполняться из-за изолированной кальцификации фиброзного кольца. Митральная регургитация на ЭхоКГ Митральная регургитация возникает в результате аномалий, влияющих на различные компоненты митрального клапана: створки, фиброзное кольцо, хорды или сосочковые мышцы. Причины митральной регургитации многочисленны по сравнению с митральным стенозом. Заболевание миокарда, особенно поражающее базальную часть левого желудочка, приводит к митральной регургитации. Менее распространенными причинами митральной регургитации являются пролапс митрального клапана, миксоматозная дегенерация, эндокардит, неишемическая дилатационная кардиомиопатия и другие инфильтративные заболевания и фиброз. |
- регионарные аномалии движения стенки с неблагоприятным ремоделированием желудочков и систолическим наклоном створок клапана,
- дилатация и изменение формы левого желудочка, которые изменяют нормальное расположение папиллярных мышц и приводят к фиксации створок и неадекватному закрытию, и
- дилатация кольца, приводящая к неадекватному сокращению кольца и неполному закрытию структур створки в систолу. Эти механизмы могут способствовать дальнейшему увеличению левого желудочка и ухудшению его функции, что само по себе увеличивает тяжесть митральной регургитации.
При ишемической митральной регургитации наблюдаются четыре клинических проявления:
- острый инфаркт миокарда,
- разрыв папиллярной мышцы,
- обратимая ишемическая дисфункция миокарда при сохраненной систолической функции левого желудочка и
- терминальная ишемическая кардиомиопатия с пониженной систолической функцией.
Острый инфаркт миокарда: митральная регургитация часто встречается при остром инфаркте миокарда, а значительная регургитация осложняет до 15% случаев. Хотя в большинстве случаев такие случаи на эхокардиографии возникают в контексте острого инфаркта миокарда, в некоторых случаях может наблюдаться острое развитие митральной регургитации.
Большинство пациентов с инфарктом миокарда, осложненным митральной регургитацией, имеют заболевание правой и огибающей коронарных артерий, которое вызывает дисфункцию нижней стенки. Таким образом, митральная регургитация на ЭхоКГ связана не с размером инфаркта, а со степенью ишемической дисфункции и вовлечением заднемедиальной папиллярной мышцы.
В результате плохая поддержка задней створки, называемая привязкой, вызывает недостаточное закрытие створки и несостоятельность клапана. Тяжелая митральная регургитация, развивающаяся после инфаркта, имеет плохой прогноз: смертность возрастает до 25% через 30 дней и более 50% через 1 год.
Влияние реперфузии миокарда на митральную регургитацию остается спорным.
Разрыв папиллярной мышцы на эхокардиографии: хотя и является редким осложнением инфаркта миокарда, полный разрыв папиллярной мышцы вызывает тяжелую митральную регургитацию и кардиогенный шок, который обычно заканчивается летальным исходом, 70% в течение 24 часов без экстренного хирургического вмешательства.
Хирургическое лечение сосочковой мышцы в большинстве случаев невозможно из-за большой площади некротической ткани; поэтому замена клапана необходима, и на ее риск влияют другие факторы, включая тяжелую дисфункцию левого желудочка, которая обычно существует. Разрыв папиллярной мышцы происходит через 2–5 дней после начала инфаркта.
Неполный разрыв, обычно только одной головки сосочковой мышцы, происходит через 4–5 дней после инфаркта с постепенным ухудшением митральной регургитации. Это усиливает ранее существовавшую дисфункцию левого желудочка.
Ишемическая митральная регургитация в нормальном левом желудочке на эхокардиографии: пациенты с длительной ишемической дисфункцией миокарда могут иметь обратимую ишемию при физической нагрузке.
Если это влияет на заднюю стенку левого желудочка, это приводит к дальнейшему ухудшению функции задней стенки и, как следствие, функции задней створки и развитию митральной регургитации.
Одышка при физической нагрузке у этих пациентов не всегда должна быть вызвана повышенным конечным диастолическим давлением, а внезапным повышением давления в левом предсердии из-за развития митральной регургитации при физической нагрузке, особенно у пациентов с расширенным левым предсердием и пациентов с плохой податливостью предсердий.
Стресс-эхокардиография идеальна для демонстрации ишемической желудочковой дисфункции и развития митральной регургитации и повышения давления в левом предсердии, отсюда положительная роль антиангинальной терапии и снижения постнагрузки. Пациентам, у которых развивается значительная митральная регургитация при стрессе и которые приняты на операцию по аортокоронарному шунтированию, следует провести восстановление митрального клапана, пластику кольца одновременно с хирургической реваскуляризацией, чтобы избежать потенциальных стойких симптомов, несмотря на успешную операцию.
Ишемическая митральная регургитация при желудочковой дисфункции на эхокардиографии: Митральная регургитация очень часто встречается у пациентов с длительной ишемической дисфункцией левого желудочка и у пациентов с терминальной стадией желудочковой недостаточностью.
Поскольку у этих пациентов створки клапана морфологически нормальные, митральная регургитация описывается как «функциональная». Трехмерная эхокардиографическая оценка митрального клапана доказывает, что сам клапан не совсем нормальный, с давними прогрессирующими изменениями межстворчатых отношений и подклапанного аппарата.
Снижение желудочкового давления может улучшить геометрию левого желудочка, а снижение артериального давления может уменьшить тяжесть митральной регургитации.
Миксоматозная дегенерация митрального клапана на эхокардиографии
Это наиболее частая причина изолированной митральной регургитации на эхокардиографии. Ее также называют дегенеративным заболеванием митрального клапана пожилого возраста или синдром выбухающего митрального клапана (синдром провисающего клапана, синдром волнообразной митральной створки, “парусящий клапан”, “баллонная деформация митрального клапана”).
Заболевание включает прогрессирующую миксоматозную дегенерацию створок митрального клапана и может варьироваться от растянутой «нормальной» створки до полностью утолщенной миксоматозной створки с выбуханием в систолу. К этому объекту применялись термины пролапс, гибкий, избыточный, миксоматозный клапан и молотящая створка.
Классические створки клапана при пролапсе на эхокардиографии утолщены, открываются в противофазе и увеличиваются в площади, а в систолу выпадают в левое предсердие. Этот процесс может повлиять на любую из двух створок, чаще всего на среднюю треть задней створки. Хорды могут стать удлиненными, истонченными и извилистыми, что предрасполагает к разрыву и острому пролапсу митрального клапана.
У пожилых людей миксоматозная митральная дегенерация обычно протекает бессимптомно. Эхокардиографически средне-позднее систолическое искривление створок> 2–3 мм кзади до точки закрытия митрального клапана рассматривается как явная демонстрация пролапса створок. В частности, при поражении двух кончиков створок миксоматоз бывает трудно отличить от вегетаций, вызванных эндокардитом.
Диагноз митрального пролапса следует ставить с левой парастернальной позиции, так как комбинация изменения формы кольца митрального клапана в систоле и закрытия клапана может показаться проявлением пролапса с других точек зрения. При синдроме Марфана миксоматозная дегенерация обычно затрагивает кончики створок, особенно переднюю створку.
Это не всегда приводит к значительной митральной регургитации, но может оставаться статическим и бессимптомным в течение многих лет. Потеря систолической коаптации и выпадение одной из двух створок в левое предсердие является высокочувствительным и специфическим признаком систолической дисфункции створки независимо от его этиологии.
Чреспищеводная эхокардиография обычно обеспечивает более четкое изображение створок и степень потери коаптации. Степень митральной регургитации с чистым пролапсом створки может быть незначительной на эхокардиографии, и клиническое обследование выявляет среднесистолический щелчок или поздний систолический шум.
Пролапс митрального клапана может предрасполагать к инфекционному эндокардиту, поэтому пациентам из группы высокого риска могут быть рекомендованы профилактический прием антибиотиков в зависимости от ситуации. Простой митральный пролапс может прогрессировать до тяжелой митральной регургитации, требующей хирургического вмешательства.
Врожденная митральная регургитация на эхокардиографии
Наиболее распространенная форма так называемой врожденной митральной регургитации на эхокардиографии — это форма, которая обнаруживается в сочетании с первичным дефектом межпредсердной перегородки или другой формой дефекта атриовентрикулярной перегородки.
В целом системный атриовентрикулярный клапан в этой группе аномалий лучше описывать как левый атриовентрикулярный клапан, а не как митральный клапан.
Другой важной причиной врожденной митральной регургитации является так называемая изолированное расщепление (расщелина) передней створки митрального клапана. По сути, клапан имеет три створки.
Важность этого диагноза заключается в том, что почти в каждом случае можно выполнить хирургическое вмешательство, наложив заплатку на переднюю створку митрального клапана, что позволяет избежать необходимости замены митрального клапана.
Инфекционный эндокардит на митральном клапане и ЭхоКГ
Это основная причина симптоматической митральной регургитации на ЭхоКГ. Вегетации развиваются на клапане и варьируются от небольших клубеньков по линии прикрепления до крупных рыхлых масс до 10 мм в диаметре и даже более, особенно при грибковой инфекции.
Поражения передней (аортальной) створки митрального клапана могут возникать в связи с эндокардитом аортального клапана, обычно с поражением правой коронарной створки. Инфекция митрального клапана также может вызвать разрыв и перфорацию створки и, следовательно, возникновение струи в нетипичном месте.
Эти поражения на эхокардиографии варьируются от локализованных аневризм до полной перфорации створок, приводящей к тяжелой митральной регургитации, требующей замены клапана.
Эндокардит может поражать нормальные клапаны, особенно у пожилых людей, но чаще всего клапаны с незначительными врожденными аномалиями или пролапс митрального клапана.
Патофизиология митральной регургитации
Объем регургитации при митральной регургитации рассчитывается как поток регургитации через область регургитации. Скорость потока через отверстие связана с разницей систолического давления между желудочками и предсердиями.
Высокое систолическое давление в левом желудочке, например системная гипертензия, увеличивает объем митральной регургитации, а низкое давление в левом желудочке снижает его.
Давление в левом предсердии при острой митральной регургитации повышается с V-зубцом в поздней систоле из-за увеличения объема и скорости поступления крови в левое предсердие.
Однако отсутствие V-зубца на записи давления в левом предсердии или давления легочного клина не исключает диагноза тяжелой митральной регургитации.
При тяжелой митральной регургитации увеличенный ретроградный ударный объем в левое предсердие вызывает увеличение прямого потока через митральный клапан в левый желудочек в последующем цикле, что увеличивает активность желудочков и скорость увеличения размера полости.
Митральная регургитация часто является динамическим поражением, и размер отверстия для регургитации и объем регургитации могут изменяться в зависимости от градиента давления на клапане и изменений объема и геометрии левого желудочка. Сама эффективная площадь регургитирующего отверстия может увеличиваться при значительно аномальной геометрии желудочков.
Таким образом, успешное уменьшение объема левого желудочка с помощью оптимальной медикаментозной терапии или кардиостимуляции и улучшение его систолической функции может способствовать снижению тяжести митральной регургитации и открытию порочного круга. Изолированная митральная регургитация связана с большим увеличением выброса левого желудочка на эхокардиографии. Общий ударный объем может быть увеличен в 3–4 раза по сравнению с нормальным. Во время открытия аортального клапана более четверти ударного объема уже могло попасть в левое предсердие. Это приводит к V-зубцу, который может достигать 50–60 мм рт.ст.
Этот объем крови повторно поступает в желудочек в раннюю диастолу, таким образом сокращая время изоволюмической релаксации и увеличивая скорость раннего диастолического наполнения, что приводит к третьему тону сердца.
Когда митральная регургитация очень тяжелая, давление в левом желудочке и левом предсердии может уравняться в середине выброса или даже раньше. Это происходит особенно при разрыве сосочковой мышцы.
Вначале конечный диастолический объем левого желудочка на эхокардиографии существенно не увеличивается, тогда как конечный систолический объем значительно снижается. Это приводит к значительному падению прямого сердечного выброса, которое может поддерживаться только синусовой тахикардией.
Разрыв сердечной стенки
Разрыв сердечной стенки, сухожильной стенки и сосочковых мышц — это распространенное осложнение инфаркта миокарда, которое возникает, когда стенки сердца теряют эластичность и утрачивают способность выполнять свои функции по перекачиванию крови.
Разрыв сердечной стенки (сухожильной стенки, сосочковой мышцы)
Сердечная стенка имеет три слоя, и самым толстым из них является мышечный слой. Этот слой называется миокардом. Эта часть сердца наиболее активна, поскольку основная функция сердечной мышцы — сжатие и расслабление с целью закачивания и выталкивания крови для передачи органам всего тела.
Даже незначительная травма или повреждение сердечной мышцы может повлиять на циркуляцию крови, привести к серьезным осложнениям или к ухудшению состояния здоровья и быстрой смерти.
Разрыв сердечной стенки (или сухожильной стенки, сосочковых мышц) происходит в мышечном слое стенки сердца.
Разрыв может происходить во внутренней части стенки, которая разделяет сердце на камеры, а также на внешней стенке, которая удерживает циркулирующую в сердце кровь.
Кроме того, от разрыва могут пострадать сосочковые мышцы — мышцы маленького размера, расположенные на сердечных клапанах, а также микроскопические сухожилия, подсоединенные к этим мышцам и сердечным клапанам и даже клапанным створкам.
Клиническая картина заболевания зависит от места, в котором произошел разрыв, чаще всего для определения заболевания применяют термин «разрыв стенки сердца» или «разрыв сосочковых мышц».
Смерть в некоторых случаях наступает практически сразу, несмотря на быструю медицинскую помощь. Однако не исключена возможность выживания пациента при своевременной экстренной помощи.
Общий прогноз в целом плохой.
Причины разрыва стенки сердца
Как уже было сказано, разрыв стенки сердца — это осложнение острого инфаркта миокарда. Кроме ИМ, вызывать разрыв сердечной стенки могут такие факторы:
- проникающие травмы сердечной мышцы;
- первичные и вторичные опухоли миокарда (злокачественные и доброкачественные);
- инфильтративные заболевания сердца и аорты;
- чрескожные процедуры, в том числе установка имплантатов;
- операции на открытом сердце, например, по замене клапана.
Клиническая картина разрыва сердечной стенки зависит от механизма повреждения (прокол, разрез, травма тупым предметом) и места повреждения, а также гемодинамики разрыва. Смертность от данного состояния в процентном отношении весьма высока, особенно без должной диагностики и отсутствия срочной хирургической помощи.
Симптомы разрыва стенки сердца
Симптомы варьируются в зависимости от места разрыва. Отверстие во внутренней стенке сердца приводит к смешиванию крови из разных камер сердца.
Разрыв наружной стенки приводит к накоплению крови в околосердечной сумке, таким образом, расширение стенок становится невозможным. Разрыв папиллярных (сосочковых) мышц образует обратный ток крови во время сокращения сердца.
Симптомы не всегда очевидны и иногда не появляются мгновенно, но в значительном числе случаев обнаружить подобное состояние можно очень быстро.
Симптомы варьируются в зависимости от места разрыва. Отверстие во внутренней стенке сердца приводит к смешиванию крови из разных камер сердца.
Разрыв наружной стенки приводит к накоплению крови в околосердечной сумке, таким образом, расширение стенок становится невозможным. Разрыв папиллярных (сосочковых) мышц образует обратный ток крови во время сокращения сердца.
Симптомы не всегда очевидны и иногда не появляются мгновенно, но в значительном числе случаев обнаружить подобное состояние можно очень быстро.
Наиболее явные симптомы таковы:
- боль в груди;
- учащение или замедление сердечного ритма;
- вздутие вен на шее;
- приглушенный звук сердцебиения, шумы, другие звуковые несоответствия норме;
- аритмия;
- отек легких;
- гемоперикард;
- шоковое состояние.
Оказать пациенту помощь необходимо максимум в течение 12 часов после инцидента. В противном случае вероятность летального исхода будет очень высока.
Лечение разрыва стенки сердца
Медикаменты применяются только для стабилизации пациента после операции или перед хирургическим вмешательством.
Используемые лекарственные препараты:
- вазодилаторы для расширения основных кровеносных сосудов и снятия избыточной нагрузки при закачивании крови в сердце;
- диуретики, увеличивающие отток жидкости таким образом, чтобы избежать отека легких и гемоперикада.
Хирургическое вмешательство, как правило, осуществляется сразу же после обнаружения проблемы. Разрывы внутренних стенок устраняются сшиванием либо использованием специального пластыря. Наружные разрывы в первую очередь требуют удаления мертвых тканей, а после — применения синтетических пластырей или биологического клея.
Разрыв сосочковых мышц является обязательным условием для замены поврежденных клапанов. Может быть показан перикардиоцентез и хирургическое дренирование гемоперикарда. После операции пациентов размещают в реанимации, прогноз зависит от общего состояния здоровья, возраста, общего состояния сердечной мышцы, наличия или отсутствия инфарктов, повторных инфарктов.
В качестве меры временной стабилизации при разрыве папиллярных мышц применяют метод баллонной контрпульсации. Этот метод не подходит для лечения пациентов с разрывом стенки левого желудочка.
Во время пребывания в реанимации больные не должны принимать пищу и питье через рот. Показан строгий постельный режим, контроль эмоционального состояния, постоянное наблюдение кардиолога.
Справочник по болезням (2012). РАЗРЫВ СОСОЧКОВЫХ МЫШЦ
Приглашаем посетить сайт
Философия (philosophy.niv.ru)
По первой буквеА Б В Г Д Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Э Я
- РАЗРЫВ СОСОЧКОВЫХ МЫШЦ
- Внутренний разрыв сердца – нарушение целости внутрипо-лостных элементов стенки сердца (межжелудочковой перегородки, сосочковых мышц) в связи с их некрозом и миомаляцией.
- Разрыв сосочковых мышц – разновидность внутреннего разрыва сердца; полный или частичный разрыв сосочковых мышц левого желудочка приводит к пролабированию створок митрального клапана в полость левого предсердия, острой недостаточности митрального клапана. Причины
- ИМ
- Ушиб сердца.
Патоморфология
80% случаев – изолированный разрыв задней сосочковой мышцы левого желудочка (как правило, при нижних ИМ), имеющей источником кровоснабжения заднюю нисходящую ветвь правой коронарной артерии. Разрыв передней сосочковой мышцы, получающей кровоснабжение из бассейна передней и огибающей артерий, возникает значительно реже
При ИМ развитие выраженной недостаточности митрального клапана обусловлено тяжёлой дисфункцией сосочковой мышцы вследствие её ишемического поражения, истончения и растяжения. Пролапс митрального клапана без разрыва сосочковой мышцы обнаруживают у 50% больных во время хирургической коррекции через 2 мес после ИМ.
Клиническая картина
Внезапное возникновение систолического шума с эпицентром над верхушкой сердца, иногда систолического дрожания над областью сердца
Острое развитие недостаточности митрального клапана – прогрессирующее ухудшение состояния больного с падением АД, картиной нарастающей левожелудочковой недостаточности, отёка лёгких и/или кардиогенного шока.
Специальные исследования
- Двухмерная эхокардиография
- Ин-вазивные методы
- Измерение давления заклинивания лёгочной
- артерии с помощью катетера Суона-Ганца
- Вентрикулография -позволяет исключить или обнаружить сброс слева направо при разрыве межжелудочковой перегородки.
Лечение:
Консервативная терапия – см. Недостаточность левожелудочковая острая.
Хирургическое лечение – протезирование митрального клапана синтетическим или биологическим протезом или клиновидная резекция створки с аннулопластикой при поражении задней сосочковой мышцы. В раннем постинфарктном периоде послеоперационная летальность достигает 50%.
Прогноз
Внезапно развившаяся митральная недостаточность при разрыве сосочковой мышцы – причина смерти 0,5% больных ИМ на сроках от первых часов до 14 дней
При полном разрыве сосочковой мышцы смерть наступает в течение нескольких часов, без хирургического лечения лишь 25% пациентов живут более 24 ч. Надрыв сосочковой мышцы или разрыв одной из нескольких её головок приводит к менее выраженной митральной регургитации. В этом случае около 70% больных живут более суток, у 50% из них продолжительность жизни превышает 30 дней.
См. также Недостаточность митрального клапана, Недостаточность сердечная, Недостаточность левожелудочковая острая
МКБ
- 123.5 Разрыв сосочковой мышцы как текущее осложнение острого инфаркта миокарда
- 151.2 Разрыв сосочковой мышцы, не классифицированный в других рубриках
- © 2000- NIV
Инфаркт сосочковой мышцы; разрыв сосочковой мышцы
В силу анатомических особенностей чаще наблюдается инфаркт и разрыв задней сосочковой мышцы у больных с диафрагмальным поражением. Клинически это обычно выражается резким нарастанием признаков левожелудочковой недостаточности у пациента с ранее относительно стабильной гемодинамикой.
Для инфаркта и, особенно, разрыва сосочковой мышцы характерно бурное нарастание отека легких, который во многих случаях сопровождается и шоком. Обычно появляется выраженный систолический шум как проявление митральной регургитации.
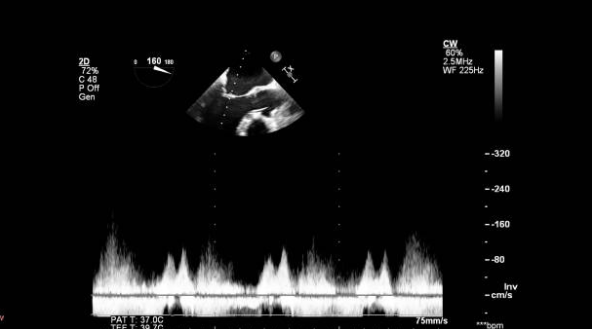
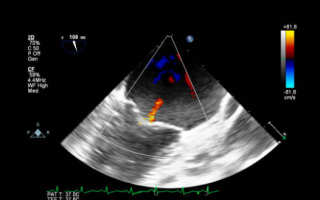
Важную диагностическую информацию дает ультразвуковое исследование сердца: картина дисфункции или разрыва сосочковой мышцы, разрыва хорд, большая амплитуда движения стенок левого желудочка, митральная регургитация 3-4 степени при цветном Допплеровском исследовании.
В отличие от разрывов межжелудочковой перегородки, нет существенной разницы в содержании кислорода в пробах крови из правого желудочка и правого предсердия. Характерно появление гигантской волны V и высокого давления заклинивания в капиллярах легких.
Как правило, больные нуждаются в хирургическом лечении (при разрыве папиллярной мышцы – всегда), при котором летальность в два раза ниже, чем при консервативном. Предоперационная стабилизация гемодинамики по схеме, описанной в разделе «Разрыв межжелудочковой перегородки».
В некоторых случаях выраженная митральная регургитация развивается у больных ИМ без разрыва или инфаркта сосочковой мышцы, как следствие обширного поражения ЛЖ с его последующей дилятацией и расширением митрального кольца или ишемией сосочковой мышцы, степень которой не приводит к её некрозу, но является причиной тяжелой дисфункции. У этих больных обычно на фоне интенсивной медикаментозной терапии и, особенно, успешного тромболизиса или ТБА, постепенно (через несколько дней) удается стабилизировать гемодинамику. Однако, если в дальнейшем сохраняется выраженная митральная регургитация (3-4 степени), вновь следует вернуться к вопросу об оперативном лечении.
10.3.3. Разрыв наружной стенки ЛЖ (внешний разрыв сердца).
Наиболее часто встречающийся вариант разрыва сердца при ИМ (до 5-6% госпитализированных с ИМпST). Ведет к развитию тампонады сердца и быстрой смерти больного.
В редких случаях внешний разрыв сердца приводит к излиянию крови в ограниченное спайками пространство полости перикарда с образованием так называемой «ложной» аневризмы сердца, основание которой представляет стенка ЛЖ, а боковые стенки и верхушка образованы перикардиальными спайками и париетальным листком перикарда. Прогноз при этом плохой, однако, описаны отдельные случаи, когда перенесшие ИМ с образованием «ложной» аневризмы сердца жили годами.
Внешний разрыв сердца чаще наблюдают при первом обширном переднем ИМ. Он более характерен для лиц пожилого возраста, скорее женщин, чем мужчин, и страдающих сахарным диабетом.
По некоторым данным, развитию внешних разрывов сердца может способствовать позднее применение ТЛТ, а также лечение кортикостероидами и нестероидными противовоспалительными средствами.
Своевременное применение реперфузионной терапии уменьшает частоту внешних разрывов сердца.
Внешний разрыв сердца может проявляться повторным ангинозным приступом, ЭКГ динамикой (резкий подъем сегментов ST, повторное развитие монофазности). Дальнейшее во многом зависит от темпов развития разрыва.
Если он останавливается на стадии надрыва (нетрансмурального) или узкого щелевидного разрыва, через который поступает в полость перикарда минимальное количество крови, процесс может приостановиться или растянуться на несколько часов – время, достаточное для уточнения диагностики (в первую очередь ультразвуковой) и подготовки оперативного вмешательства. Однако, в большинстве случаев внешние разрывы сердца быстро приводят к тампонаде сердца, электромеханической диссоциации, потере сознания и скоропостижной смерти. Описаны отдельные случаи успешного оперативного вмешательства (экстренный перикардиоцентез с возвратом крови больному и последующая пластика разрыва) и при катастрофически быстром развитии наружного разрыва сердца, но они редки.
Острая аневризма ЛЖ.
Острая аневризма ЛЖ развивается обычно при обширных инфарктах передней стенки ЛЖ. Наблюдается значительно реже при адекватном использовании реперфузионной терапии.
При острой аневризме ЛЖ увеличивается вероятность разрыва сердца, а также таких осложнений, как сердечная недостаточность, нарушения ритма сердца, перикардит, тромбоз полости ЛЖ, периферические тромбоэмболии.
Возможности физикальной диагностики аневризмы ЛЖ значительно уступают инструментальным методам, в первую очередь, ультразвуковому исследованию сердца, которое позволяет не только уточнить особенности геометрии и локальной сократительной функции ЛЖ, но и оценить такие сопутствующие осложнения как перикардит и тромбоз полости ЛЖ.
Последний обнаруживается практически всегда при аневризме сердца и не менее, чем в половине случаев обширных передних ИМ.
Ультразвуковое исследование сердца позволяет уточнить такие характеристики тромбоза полости ЛЖ, как его гомогенность и подвижность свободного края, которые во многом определяют вероятность фрагментации тромба и развитие периферических тромбоэмболий.
Лечение симтоматическое, однако, при сопутствующих опасных для жизни аритмиях или тяжелой сердечной недостаточности, плохо контролируемых медикаментозно, возможно хирургическое лечение.
Продолжительная терапия антикоагулянтами непрямого действия (варфарин), в дозе, обеспечивающей поддержание МНО в диапазоне 2,0-3,0, показана при повышенной опасности периферических тромбоэмболий и продолжается до тех пор, пока по данным ультразвукового исследования тромб не станет более плотным, гомогенным и исчезнет подвижность его свободного края или сам тромб вообще.
Артериальные тромбоэмболии.
Тромбоэмболии периферических и мозговых артерий диагносцируются у 3-4% больных ИМпST. Предрасполагающими факторами являются обширные передние ИМ, часто сопровождающиеся развитием тромбоза полости ЛЖ, локальное атеросклеротическое поражение, протромботические изменения со стороны крови, сердечная недостаточность, фибрилляция предсердий.
Чаще всего наблюдаются (1-1,5%) и имеют наиболее неблагоприятный прогноз тромбоэмболии мозговых сосудов. Развитие этого осложнения на фоне ТЛТ требует ее прекращения. Обычно прекращают и гепаринотерапию.
Антиагрегантная терапия (АСК, клопидогрел или их комбинация, но не блокаторы ГП IIb/IIIa рецепторов тромбоцитов) продолжается в полном объеме.
Обнаружение источника эмбола (обычно тромбоз полости ЛЖ) требует подключения антикоагулянтов непрямого действия (предпочтительно варфарина), что следует рассматривать скорее как меру вторичной профилактики.
Фибрилляция предсердий также требует лечения антикоагулянтами непрямого действия, если это не было сделано до развития тромбоэмболии. Если источником тромбоэмболии служит распадающаяся бляшка в сонной артерии (данные ультразвукового исследования или магнитно-резонансной томографии), следует рассмотреть вопрос о стентировании соответствующего сосуда.
Ишемическое нарушение мозгового кровообращения может быть обусловлено не только тромбоэмболией, но и тромбозом мелких артерий мозга, а также системными нарушениями гемодинамики, ведущими к артериальной гипотензии и развитию ишемического инсульта на фоне предсуществующего стенозирования артерий, снабжающих мозг кровью (в первую очередь сонных и позвоночных). Поэтому контроль за гемодинамикой, особенно у пожилых и имеющих анамнестические указания на нарушения мозгового кровообращения – важный метод профилактики ишемического мозгового инсульта.
При ИМпST описаны тромбоэмболии практически всех периферических артерий. Чаще других отмечают тромбоэмболии артерий ног и почек. Клиническая картина тромбоэмболии артерий ног во многом зависит от ее уровня, наличия коллатералей, выраженности сопутствующего спазма и ряда других факторов.
Тромбоэмболия бедренной и даже подколенной артерии может сопровождаться тяжелыми болями и существенно влиять на общую гемодинамику. В этих случаях наряду с медикаментозной терапией (гепарин, антиагреганты и пр.), решается вопрос и об оперативном лечении – эмболэктомии.
Эффективность ТЛТ оценивается неоднозначно.
Тромбоэмболия почечных артерий может сопровождаться болями в поясничной области (иногда выраженными) и в животе, гематурией.
При поражении крупной ветви почечной артерии может наблюдаться подъем АД, обычно преходящий, и временная олигурия. Специального лечения, кроме обезболивания, как правило, не требуется.
При массивной гематурии следует прекратить введение антикоагулянтов. Тромбоэмболия с окклюзией ствола a. renalis встречается крайне редко.
Тромбоэмболия мезентериальных артерий проявляется болями в животе, парезом кишечника. При неблагоприятном развитии – некроз кишечника. К этому может присоединиться картина перитонита. У пожилых и ослабленных больных клиническая картина часто стерта и диагноз затруднителен. Оперативное вмешательство в этой ситуации переносится тяжело, но является единственно реальным методом лечения.
Осложнения инфаркта миокарда
Клиническое течение инфаркта миокарда (ИМ) нередко отягощается различными осложнениями. Их развитие обусловлено не только размерами поражения, но и комбинацией причин.
Острая сердечная недостаточность
СН считается одним из самых тяжелых осложнений инфаркта миокарда. Согласно классификации исследователя Киллип, при ИМ существует 4 класса выраженности ОСН:
- I класс — не наблюдается хрипов в легких и ритма галопа; этот класс фиксируют у 40-50% больных, при этом уровень смертности достигает 3-8%.
- II класс — обнаруживаются хрипы, они выслушиваются на площади менее 50% легочных полей, или же обнаруживается наличие ритма галопа; бывает у 30-40% больных, смертность составляет 10-15%.
- III класс — обнаруживаются хрипы на площади от 50% легочных полей, также есть ритм галопа; этот класс фиксируют у 10-15% больных, смертность колеблется от 25 до 30%.
- IV класс — обнаруживаются признаки кардиогенного шока; данный класс возникает у 5-20% больных, смертность достигает 50-90%.
Ухудшает прогноз появление проявлений сердечной недостаточности при инфаркте миокарда.
Чтобы вовремя обнаружить застой в легких, нужно несколько раз внимательно выполнять аускультацию легких на протяжении первых 24 часов. С помощью ЭхоКГ можно обнаружить ранние изменения сократительной функции миокарда и начальные проявления ремоделирования сердца.
Ремоделирование миокарда
Оно предшествует симптоматике сердечной недостаточности, поэтому важное значение имеет адекватная оценка и его терапия. Для предупреждения ремоделирования миокарда важное значение имеют ингибиторы АПФ. Они назначаются пациентам, если даже нет проявлений СН, если через 1-2 суток после начала ИМ обнаруживается снижение фракции выброса левого желудочка менее 40%.
Как правило, назначается троекратный в сутки прием каптоприла (дозировка 6,25 мг), 1-2-кратный прием 2,5 мг эналаприла или же однократный прием 2,5 мг рамиприла. Важно, чтобы у человека не было противопоказаний к данным лекарствам. Далее нужно увеличить дозу ингибиторов АПФ до уровня, который максимально переносим данным больным.
Проявлениями острой сердечной недостаточности может быть кардиогенный шок и отек легких.
Кардиогенный шок
Развивается как результат резкого снижения сердечного выброса. В основном шок возникает при обширном инфаркте миокарда на фоне многососудистого поражения венечных артерий. Кардиогенный шок фиксируют при вовлечении более 40% массы миокарда, он наблюдается у 5-20% пациентов с диагнозом «инфаркт».
Факторы риска развития кардиогенного шока:
- уменьшение фракции выброса левого желудочка ниже нормы (по данным ЭхоКГ);
- пожилой возраст;
- предшествующий инфаркт миокарда;
- большие размеры ИМ (согласно данным ЭКГ, инфарктные изменения в 8-9 отведениях; большая зона акинезии по данным ЭхоКГ);
- сахарный диабет.
- Патогенез
- Ниже перечисленные факторы усугубляют ишемию миокарда.
- Задержка жидкости по причине снижения почечного кровотока и увеличение объема циркулирующей крови, что максимизирует преднагрузку на сердце, вызывает отек легких и гипоксемию.
Активация симпатической нервной системы как следствие падения сердечного выброса и снижения артериального давления. Учащается ритм сердца и усиливается сократительная деятельность миокарда, потому сердце еще больше нуждается в кислороде.
Нарушение диастолического расслабления левого желудочка миокарда по причине нарушения его наполнения и снижения податливости. Как следствие: увеличивается давление в левом предсердии и усиливается застой в легких крови.
- Повышение периферического сосудистого сопротивления по причине вазоконстрикции, что приводит к увеличению постнагрузки на сердце, миокард всё больше испытывает потребность в кислороде.
- Метаболический ацидоз как следствие долго существующей гипоперфузии органов и тканей.
- Симптомы
- Симптомы делятся на три большие группы:
- Нарушение периферической перфузии: поражение почек проявляется олигурией; поражение кожных покровов — бледностью, повышенной влажностью; поражение ЦНС — психическии нарушениями.
- Артериальная гипотензия: систолическое артериальное давление ниже 90 мм рт.ст. или на 30 мм рт.ст. меньше обычного уровня на протяжении получаса и даже дольше. Сердечный индекс составляет меньше 1,8-2 л/мин на м2.
- Отек легких.
Медики при обследовании человека находят нарушение сознания, холодность рук и ног, артериальную гипотензию (среднее артериальное давление ниже 50-60 мм рт.ст.), глухие тоны сердца, тахикардию, олигурию (< 20 мл в мину). При аускультации легких могут быть обнаружены влажные хрипы.
Специальные методы исследования
- Артериовенозная разница по кислороду более 5,5 мл%.
- Увеличение давления наполнения левого желудочка (давления заклинивания легочных капилляров) больше 18 мм рт.ст.
Диагностика
Врачу важно исключить другие причины артериальной гипотензии для назначения правильного лечения и ведения больного:
- вазовагальные реакции;
- гиповолемию;
- аритмии (например, пароксизмальные наджелудочковые и желудочковые тахикардии);
- электролитные нарушения (например, гипонатриемию);
- побочные эффекты лекарственных препаратов.
- Лечение кардиогенного шока как осложнения ИМ
- Кардиогенный шок — это неотложное состояние, потому необходимо экстренное лечение.
- Основная цель проводимой терапии — повышение артериального давления.
• Лекарства. С их помощью АД нужно повышать до 90 мм рт.ст. и выше. Актуальны такие препараты (в основном их вводят через специальные дозаторы).
- – Допамин (может увеличить частоту сердечных сокращений и, соответственно потребность миокарда в кислороде, несколько усугубив тем самым ишемию миокарда) в дозе 2-10 мкг/(кгхмин), дозу постепенно увеличивают каждые 2-5 минут, пока она не достигнет 20-50 мкгДкгхмин).
- – Добутамин (доза составляет 2,5-10 мкгДкгхмин)
- – Норадреналипа гидротартрат в дозе 2-4 мкг/мин (до 15 мкг в минуту), но наряду с усилением сократимости миокарда он сильно увеличивает периферическое сосудистое сопротивление, что также может усугубить ишемию миокарда.
• Внутриаортальная баллоппая коптрпульсация. При наличии соответствующего оборудования и неэффективности лекарственного лечения кардиогенного шока проводят внутриаортальную баллонную контрпульсацию. Суть заключается в уменьшении работы левого желудочка по преодолению сопротивления выбросу крови в аорту.
Такой эффект достигается при помощи насоса, который подключен к бедренным или подвздошным артериям и снижает давление в аорте в начале систолы или пресистолы. В фазу диастолы эвакуированная кровь нагнетается обратно в артериальную систему, что улучшает центральную гемодинамику и увеличивает коронарный кровоток.
• Чрескожная транслюминальная коронарпая ангиопластика. Восстановление проходимости венечных артерий с ее помощью в первые 4-8 часов после начала инфаркта не только сохраняет миокард, но и прерывает порочный круг патогенетических механизмов кардиогенного шока.
Наблюдение. При кардиогенном шоке нужно постоянно контролировать артериальное давление, частоту сердечных сокращений, диурез (постоянный мочевой катетер), давление заклинивания легочных капилляров (баллонный катетер в легочной артерии), а также контроль сердечного выброса с помощью метода ЭхоКГ или радионуклидной ангиографии.
Прогноз. Смертность при кардиогенном шоке составляет 50-90%.
Разрыв стенки левого желудочка
Разрыв стенки левого желудочка с тампонадой сердца диагностируют у 1-3% пациентов с диагнозом «инфаркт миокарда».
Из этого количества пациентов примерно у 30-50% разрыв случается на протяжении первого часа, у 80-90% — на протяжении первых 2 недель.
Разрыв свободной стенки левого желудочка возникает в основном при обширном инфаркте миокарда, а также на фоне артериальной гипертензии или при отсутствии предшествующей стенокардии.
Что касается симптоматике, при разрыве бывают всегда интенсивный болевой синдром, внезапное исчезновение пульса, резкое падение артериального давления (что не определяется при сфигмоманометрии) и потеря сознания, причем сохраняется электрическая активность (согласно данным ЭКГ), что медики называют электромеханической диссоциацией. В основном исходом разрыва сердца является смерть человека.
В четверти случаев фиксируют подострый разрыв стенки левого желудочка, который может напоминать неопытным врачам инфаркт миокарда, потому что снова появляются болт и подъем сегмента 5Т, при этом артериальное давление падает. Начинабт проявляться характерные для тампонады сердца симптомы, что верифицируют при помощи ЭхоКГ. Единственным методом терапии является хирургическое вмешательство.
Разрыв межжелудочковой перегородки
Фиксируется у 1-3% пациентов с инфарктом миокарда. Что характерно, в 20-30% случаев развивается на протяжении первых суток. После 2 недель это осложнение возникает крайне редко. Более чем в половине случаев в течение 7 дней человек умирает, а 92% больных, согласно статистике, умирает при этом осложнении на протяжении 12 месяцев.
Основная симптоматика проявляется громким систолическим шумом с проведением вправо от грудины и клиническим ухудшением состояния человека по причине выраженной левожелудочковой недостаточности. Медикам нужно учитывать, что при остром разрыве шум может быть мягким или не выслушивается вовсе.
Основной метод, который используют для подтверждения дефекта, — ЭхоКГ в допплеровском режиме.
Недостаточность митрального клапана
Недостаточность митрального клапана незначительной при ИМ бывает фактически у 50% пациентов, а выраженная степень отмечается у 4%. При выраженной степени умирает около четверти человек. Среди причин этого осложнения ИМ называют дисфункцию или разрыв сосочковых мышц. Чаще всего возникает именно дисфункция сосочковых мышц.
Поражена в большинстве случаев задняя сосочковая мышца. Обнаруживается систолический шум на верхушке сердца. Разрыв сосочковых мышц характерен примерно для одного процента пациентов с ИМ. Опять таки, чаще происходит поражение задней сосочкой мышцы. Что касается клинических проявлений, возникает грубый систолический шум и отек легких на вторые-седьмые сутки после начала ИМ.
Для подтверждения диагноза важно провести ЭхоКГ.
Синусовая брадикардия
Возникает в частых случаях, особенно при ИМ нижней стенки левого желудочка. При выраженной артериальной гипотензии нужно ввести 0,3-0,5 мг атропина в/в, при необходимости делают повторные инъекции (максимальная суммарная доза должна составлять 1,5-2,0 мг).
АВ-блокада
АВ-блокада I степени в большинстве случаев не требует лечения. При АВ- блокаде II степени 1-го типа как осложнения инфаркта миокарда нижней стенки левого желудочка, редко нарушается гемодинамика. Если проявления нарушения динамики крови становятся всё большими, нужно ввести атропин или установить временный ЭКС.
Аневризма левого желудочка
Это локальное парадоксальное выбухание стенки левого желудочка (дискинезия); является поздним осложнением инфаркта миокарда. Аневризма представляет собой с точки зрения патоморфологии соединительнотканный рубец, который постепенно может кальцифицироваться. В аневризме может находиться тромб. Для диагностики этого осложнения проводят ЭКГ, ЭхоКГ.
Перикардит
Наблюдается в 6-11% случаев ИМ. Развитие происходит на вторые-четвертые сутки от начала инфаркта миокарда. При остром перикардите врач выслушивает шум трения перикарда. Если шум слабый, больного нужно слушать, когда он стоит.
Другим проявлением при инфаркте миокарда является боль в грудной клетке. Перикардиальная боль не «отдает» в шею и руку. Она усиливается, когда больной глотает, вдыхает, кашляет. При перикардите, который сопровождает ИМ, температура можно повышаться 39 °С, и это длится от 3 суток.
Для неосложненного инфаркта миокарда это нетипично.