Если беспокоит слабость, недомогание и одышки, то вероятно стоит записаться на прием к терапевту. Он уже в свою очередь после выслушивания жалоб и первичного визуального осмотра. Перенаправит к более узко специализированному врачу за консультацией – к кардиологу.
Кто такой кардиолог
Кардиолог – это специалист широкого профиля. Занимается диагностикой, лечением врожденных и приобретенных патологий сердца, сосудов.
Особая роль отводится профилактике и проведению разъяснительной беседы с пациентами. Делается это во избежание развития и рецидивов серьезных патологий, связанных с сердцем, сосудами.
Кардиология — обширное направление в медицине, поэтому врач – кардиолог может иметь более узкую специализацию:
- ангиолог с проведением мероприятий по выявлению и лечению нарушений сердечного ритма;
- аритмолог, занимающийся восстановление и сохранностью работы органов сердечного отдела;
- кардиоревматолог, у кого консультация может потребоваться при уже имеющемся заболевании сердца. Или после перенесенного инфаркта, оперативного вмешательства;
- флеболог, запись на приём к которому может стать жизненный необходимостью. При васкулите, тромбофлебите, варикозном расширении вен;
- кардиохирург, проводящий открытые (закрытые) операции на сердце;
- ангиохирург – специалист по сосудам.
Особой деятельностью занимается детский кардиолог — специалист в особенностях строения сердца у детей до 18 лет. Способный быстро выявить врождённые (приобретённые) пороки. Поставить точный диагноз и провести лечебные действия, операцию на сердце в случае необходимости.
Какие патологии сосудов лечит
- сердечная недостаточность (любой этиологии);
- аритмия;
- ишемия;
- стеноз аортального, трехстворчатого, митрального, пульмонального клапана;
- аневризма аорты;
- стенокардия;
- тромбофлебит, тромбоз;
- травма сердца;
- опухоль;
- атеросклероз;
- врожденный (приобретенный) порок сердца и клапанов;
- брадикардия;
- тахикардия;
- гипертония, гипотония;
- постинфарктный кардиосклероз.
- своевременно выявить либо предупредить заболевание сердца;
- провести меры предупреждению развития осложнений или вторичную профилактику (если заболевание сердца прогрессирует);
- подобрать оптимальные методики лечения с индивидуальным подходом к каждому пациенту;
- отслеживать самочувствие больного, пережившего открытую (закрытую) операцию на сердце в реабилитационный период.
Практически все болезни сердца связаны с нарушениями функций миокарда. При подозрениях, появлении неприятных симптомов нельзя откладывать посещение кардиолога и прохождение диагностики.
При каких симптомах надо обращаться к кардиологу
Обратиться к кардиологу стоит, если наблюдается:
- посинение губ, мочек уха;
- бледность покровов кожи;
- отечность конечностей;
- одутловатость лица;
- учащение пульса, сердцебиения свыше 100 уд/мин;
- одышка с возникновением даже в состоянии покоя;
- скачки давления;
- головокружение;
- частые головные боли, особенно после переживаний, переутомления;
- беспричинное прибавление лишних килограмм;
- колющая, ноющая боль за грудиной, в сердце;
- гипертонический криз.
Обязательная консультация у кардиолога проводится для:
- женщин на стадии планирования беременности, также на начальных сроках;
- диабетиков;
- людей, страдающих повышенным уровнем холестерина или с избыточной массой тела.
В группу риска входят пациенты, ближайшие родственники которых страдали ранее заболеваниями сосудов и сердца.
Где принимает кардиолог, цены
Обратиться в регистратуру, получить талон для проведения первичной бесплатной консультации и диагностики.
Лучшие кардиологи по сосудам принимают на платной основе в частных клиниках, кардиоцентрах. Цена за услугу в среднем обходится -1200-2100 руб.
Что делает кардиолог при приеме пациента
Первичный осмотр кардиолога начинается с:
- выслушивания жалоб, беспокоящих симптомов;
- сбора информации о пациенте;
- выяснения, не страдали ли заболеваниями сердца прямые родственники. Нет ли у пациента заболевания крови (эндокринной системы). Не был ли обнаружен ранее сахарный диабет, проводилась ли операция на сердце;
- наличие вредных привычек, наследственной предрасположенности;
- прощупывание области сердца, проведение перкуссии или постукивания пальцами;
- прослушивание шумов в сердце стетоскопом;
- измерение артериального давления тонометром;
- выявление пульсации на руке для получения сведений о частоте сердечных сокращений;
- проведение электрокардиографии, эхокардиографии.
Пациентам важно понимать, как проходит прием у кардиолога. Это облегчает задачу для проведения подготовительных процедур и сбора заранее необходимых анализов.
Какие методы диагностики сосудов использует кардиолог
- общий анализ крови на креатинин, мочевину, уровень печеночных ферментов. Позволяющий выявить причины жалоб у пациентов, хотя и не имеет прямого отношения к сердечно-сосудистым патологиям;
- анализ мочи (общий) для получения оценки количества СОЭ, лейкоцитов, гемоглобина, эритроцитов. Так преобладающие число лейкоцитов наблюдается при перикардите, инфаркте миокарда. А низкий гемоглобин — при кислородном голодании сердечной мышцы и аритмии;
- анализ крови на биохимию с целью выявления количества глюкозы (%). При подозрении на развитие атеросклероза, сахарного диабета
Аппаратные методы исследования:
- электрокардиография;
- рентгенография органов грудной клетки;
- коронарная ангиография;
- чреспищеводная электрическая стимуляция сердца (эхокардиография);
- ангиокардиография, катетеризация сердца;
- сфигмография;
- МРТ;
- позитронно-эмиссионная томография;
- холтеровское мониторирование;
- фонокардиография;
- дуплексное сканирование сосудов.
Иногда врачом назначается суточный мониторинг за работой сердца (артериального давления). С прикреплением к телу пациента небольших переносных устройств.
Как проходит лечение
Заболевания сосудов требуют комплексного подхода к лечению. Чаще всего назначаются медикаменты различных фармакологических групп:
- антикоагулянты (Варфарин, Гепарин) во избежание свертываемости крови;
- препараты с нитратами (Нитроминт, Нитроглицерин) для снижения ишемии миокарда, улучшения функции коронарных сосудов;
- антиагреганты (Тиклопидин, Аспирин) для предотвращения тромбообразования;
- бета-блокаторы (Атенолол, Пропранолол) с целью минимизации частоты сердечного ритма;
- диуретики (Верошпирон, Фуросемид) для снятия отечности, нормализации показателей давления частности.
Возможны назначения сердечных гликозидов, блокаторов рецепторов ангиотензина 2, ингибиторов АПФ.
Ни в коем случае нельзя принимать медикаменты без разрешения врача. Во избежание развития осложнений и ухудшения самочувствия. При обращении впервые, пациентам важно понимать, с какими анализами нужно идти на прием к кардиологу.
Выбор тактики должен нести максимальную пользу и снизить риски для жизни и здоровья пациента.
Зачастую к проведению процедур подключаются сосудистые хирурги с проведением операций. И последующей катетеризацией полости сердца или крупных вен.
Варианты проводимых операций:
- баллонная ангиопластика;
- стентирование крупных сосудов, коронарных артерий;
- протезирование митрального клапана;
- шунтирование сосудов в обход пораженных участков;
- перикардиоцентез для устранения тампонады сердца;
- трансплантация, как редкая процедура, но применимая при лечении врожденных пороков сердца у детей.
Необходимость в проведении операции возникает при следующих заболеваниях сердечно — сосудистой системы:
- тромбангиит;
- тромбофлебит;
- тромбоз вен;
- варикоцеле;
- диабетическая ангиопатия;
- варикозное расширение вен;
- энцефалопатия;
- нарушение проходимости брахиоцефальных сосудов.
Рекомендации врача
Узнать, как правильно питаться и какой образ жизни вести. Не допустить развития сложных заболеваний сердца и сосудов, значит:
- устранить негативные привычки (курение, алкоголь);
- отказаться от чрезмерного приема крепкого кофе, чая, энергетиков;
- пресекать конфликтные ситуации, стрессы;
- больше гулять на свежем воздухе;
- проводить водные процедуры, массаж;
- дозировать спорт, занимаясь 3-4 раза в неделю;
- наладить питание, включив полезные для сердца и сосудов рыбу, орехи, нежирное мясо, злаки, фрукты, овощи;
- бороться с весом, поскольку именно лишние килограммы приводят к износу сердца и увеличению нагрузки.
Поэтому врачи советуют вести размеренный образ жизни, восстанавливать периодически душевное равновесие:
- проводить массаж, арт-терапию;
- заниматься медитацией;
- не нагружать сердце, заставляя работать в усиленном режиме;
- 1 раз в год проходить осмотр у кардиолога. Особенно при наследственной предрасположенности к развитию сердечных заболеваний. Или мужчинам в пожилом возрасте, незастрахованных от скоротечного развития инсульта, инфаркта миокарда, сердечного приступа.
Коварность заболеваний сердца и сосудов – бессимптомное течение на первых порах. Бездействие может к инвалидности и смертности. Диагностикой и лечение занимается врач – кардиолог.
Читать еще: Специфика мужского микроинсульта
Если постоянно беспокоит одышка и боль в сердце. То пришло время записаться на консультацию к опытному специалисту.
COVID-19: советы кардиолога
02.Апр.2020
Ольга Валерьевна, есть ли связь между болезнями системы кровообращения и COVID-19? Наличие сердечно-сосудистой патологии никак не взаимосвязано с высоким риском заражения коронавирусом, но существует опасность более острого течения заболевания. Это может привести к декомпенсации, то есть нарушению функций органа или системы органов.Это очень опасное состояние, при котором организм не может самостоятельно справиться с проблемой, используя необходимые резервы.
Коронавирус бьет по сердцу?
Мало кто знает, но любое инфекционное заболевание может негативно отразиться на работе сердца.Оно уязвимо для многочисленных патогенных микроорганизмов, проникающих в тело человека. COVID-19 требует выбора приоритетной тактики лечения в каждой конкретной ситуации.Грипп или коронавирус могут вызывать пневмонию и повлиять на способность легких доставлять кислород, это создаёт дополнительную нагрузку на сердце.
Ольга, Валерьевна, режима самоизоляции в первую очередь должны придерживаться люди старше 65 лет. С чем это связано?
Любые инфекции сильнее сказываются на людях, у которых есть проблемы со здоровьем. Пожилые люди должны особенно беречь себя от контактов в социуме в период пандемии. У них чаще других встречается сочетание нескольких заболеваний: гипертонии, сахарного диабета и ишемической болезни сердца. Чтобы не заразиться, таким пациентам нужно придерживаться несложных профилактических мер: ограничить контакты, находиться дома, чаще мыть руки с мылом, избегать любых людных мест и поездок на общественном транспорте, а при возникновении признаков недомогания вызывать врача.
Насколько важно соблюдать рекомендации кардиолога?
Очень важно продолжать прием назначенных вам лекарств. Даже если вы заболели любой инфекцией, вызывающей простуду или грипп, нельзя самостоятельно отменять терапию. Важно иметь запас медикаментов на случай, если нет возможности выйти из дома в аптеку. Как правило, у наших пациентов в аптечке всегда есть необходимые лекарства.
Сейчас большинство пациентов находятся в режиме самоизоляции. Что им делать, если вдруг возникают вопросы по дозировке препарата и режиме его приема?
Специально для пациентов Ккрдиодиспансера, которым из-за режима самоизоляции не могут очно посетить врача, мы организовали дополнительный кардиологический дистанционно-консультационный пункт. Это помощник для людей с хроническими сердечно-сосудистыми заболеваниями, и тех, кто недавно перенес операцию на сердце. Номер КДКП: 8-951-977-90-60.Телефон работает в будни с понедельника по пятницу с 08:00 до 17:00.
Ольга, Валерьевна, что можете еще посоветовать пациентам?
Уважаемые пациенты, помните, что все ограничительные мероприятия временны и направлены на сохранение здоровья! Находясь в режиме самоизоляции не забывайте про здоровый образ жизни: при отсутствии противопоказаний делайте легкую зарядку, высыпайтесь и настраивайтесь на позитив!
Применение Диакарба при лечении сердечно-сосудистых заболеваний
Для специалистов 02 мая 2019
Работы, посвященные оценке эффективности применения ацетазоламида при лечении хронической сердечной недостаточности (ХСН) появились еще в 50-е годы XX века [1, 2]. Тем не менее длительное время этому препарату отводилась весьма скромная роль в лечении сердечно-сосудистых заболеваний. В четвертом издании известного учебника по клинической фармакологии, вышедшем в 1973 г, D.R. Laurence отметил, что «применение ацетазоламида имеет в основном теоретический, но не практический интерес» [3]. Мнение о роли ацетазоламида при лечении разных заболеваний за прошедшие 30 лет существенно изменилось. В настоящее время ацетазоламид используется не только при глаукоме [4], эпилепсии [5, 6] и высокогорной болезни [7, 8], но также при лечении сердечной [9] и легочно-сердечной недостаточности [10]. Применяется он и для лечения такой редкой неврологической патологии, как гипокалиемический периодический паралич [11]. В настоящем обзоре будут рассмотрены наиболее важные аспекты применения ацетазоламида при сердечно-сосудистых заболеваниях.
Фармакологические свойства ацетазоламида
Ацетазоламид —N-[5-(Аминосульфонил)-1,3,4-тиадиазол-2-ил]ацетамид — ингибитор карбоангидразы — относительно слабый диуретик [12], поскольку его подавляющее действие на карбоангидразу ограничивается вызываемым терапией ацидозом и сопутствующим увеличением реабсорбции натрия в дистальных почечных канальцах.
После приема внутрь ацетазоламид быстро всасывается из желудочно-кишечного тракта. Его максимальная концентрация в крови (Cmax) после приема 500 мг достигается через 1—3 ч и составляет 12—27 мкг/мл; определяемая концентрация в плазме сохраняется в течение 24 ч после приема препарата [13].
Ацетазоламид проникает через плацентарный барьер, а также в небольших количествах в грудное молоко. Применение ацетазоламида в терапевтических концентрациях сопровождается высокой связью с белками плазмы (>96%). Выведение из организма происходит за счет активной секреции в проксимальных канальцах почек [14, 15].
Препарат не накапливается в тканях.
Диуретический эффект основан на угнетении активности карбоангидразы в почках и изменении кислотно-основного состояния в организме. Он действует главным образом на проксимальные канальцы.
Угнетение карбоангидразы приводит к уменьшению образования угольной кислоты и снижению реабсорбции бикарбоната и ионов натрия эпителием канальцев; повышается выделение с мочой ионов натрия и бикарбонат-ионов, в связи с чем увеличивается выделение воды; рН мочи повышается. Увеличения выделения хлоридов не происходит.
В экспериментальных исследованиях на человеке было показано, что применение ацетазоламида сопровождается прямым сосудорасширяющим действием, которое обусловлено активацией калиевых каналов, регулируемых кальцием (KCa каналы) [16, 17]. Ацетазоламид был первым препаратом, для которого была доказана способность воздействия на эти каналы.
Применение ацетазоламида у больных с тяжелой сердечной недостаточностью при развитии устойчивости к действию диуретиков
У больных с ХСН, не имеющих нарушения функции почек, 99% профильтровавшихся ионов натрия реабсорбируется в почечных канальцах [18].
Примерно две трети ионов натрия подвергается обратному всасыванию в проксимальных канальцах [19], оставшаяся в просвете канальцев часть ионов натрия попадает в область петли Генле — месте действия петлевых диуретиков, которые, подавляя реабсорбцию натрия, приводят к выведению с мочой ионов натрия, хлора, калия и водорода [20]. Эффективность применения петлевых диуретиков в значительной степени зависит от количества ионов натрия в области петли Генле — при снижении их концентрации в этой зоне, применение петлевых диуретиков становится неэффективным из-за отсутствия субстрата их действия. Сниженный кровоток в почках при ХСН способствует уменьшению количества ионов натрия, выделяемого в просвет петли Генле [20].
Истинная частота развития устойчивости к действию петлевых диуретиков у больных с ХСН неизвестна [21].
При ретроспективном анализе 1153 больных с выраженной ХСН, включенных в исследование PRAISE (Prospective Randomized Amlodipine Survival Evaluation), устойчивость к диуретикам отмечалась у 402 больных (устойчивость определялась как потребность в применении фуросемида в дозе >80 мг/сут или буметанида >2 мг/сут) [22]. Epstein M. et al.
[23] определяют устойчивость к действию диуретиков более строго — как неспособность выделять ≥90 ммоль натрия в течение 72 ч после приема фуросемида по 160 мг 2 раза в день. Резистентность к диуретикам обычно развивается у больных с фракционной экскрецией ионов натрия намного ниже нормального уровня (0,2%) [24].
Анализ данных исследования PRAISE также выявил, что развитие устойчивости к применению диуретиков при ХСН — независимый прогностический показатель неблагоприятного исхода (стандартизованное отношение риска для смерти, внезапной смерти и левожелудочковой недостаточности при использовании высоких доз диуретиков составило 1,37; 1,39 и 1,51 соотв.) [22].
Снижение эффективности применения петлевых диуретиков может быть обусловлено несколькими причинами [25]. Кратковременная потеря эффективности проявляется в снижении ответа на повторное применение диуретика вскоре после первого введения.
Ее можно преодолеть за счет восстановления объема плазмы, уменьшившегося в результате применения диуретической терапии [26—28]. Хотя точный механизм этого вида устойчивости к действию диуретиков остается неясным, предполагается, что ее развитие связано с активацией ренин-ангиотензиновой и симпато-адреналовой систем.
Медикаментозное подавление активации этих систем тем не менее не приводит к предотвращению развития этого типа устойчивости [27, 29, 30].
При длительном применении петлевых диуретиков, подавление реабсорбции ионов натрия в области петли Генле, обуславливает попадание их в более дистальные участки нефрона. Это приводит к развитию гипертрофии дистальных сегментов нефрона с соответствующим увеличением реабсорбции натрия в них [31—35].
Усиление реабсорбции натрия в дистальных канальцах сопровождается снижением диуреза. Развивается устойчивость к действию петлевых диуретиков.
Применение тиазидных диуретиков блокирует реабсорбцию натрия в дистальных канальцах, позволяя преодолеть этот тип устойчивости к действию петлевых диуретиков [23, 36—38].
Увеличение реабсорбции ионов натрия в проксимальных почечных канальцах — еще один важный механизм развития устойчивости к диуретикам при ХСН.
В этих случаях повышенная реабсорбция натрия в проксимальных канальцах приводит к снижению их доставки в дистальные отделы нефрона, обуславливая неэффективность применения петлевых диуретиков [39—42].
Назначение ацетазоламида позволяет преодолеть этот тип устойчивости у больных, не отвечающих на применение высоких доз петлевых диуретиков и у больных с метаболическим алкалозом.
Отдельные авторы высказывают сожаление о том, что современные клинические рекомендации по лечению больных с ХСН Американской ассоциации сердца, Американской коллегии кардиологов и Американского общества по сердечной недостаточности не содержат советов по лечению больных с развившейся устойчивостью к действию диуретиков [43]. В этих условиях тактика лечения ХСН, устойчивой к применению диуретиков, основывается на результатах небольших исследований и подходах, сложившихся в клинической практике.
В исследовании, включавшем здоровых добровольцев, было показано, что при повышенной реабсорбции натрия в проксимальных канальцах за счет значительного ограничения потребления натрия с пищей применение ацетазоламида и фуросемида оказывает синергетический эффект [44].
Рандомизированные клинические исследования эффективности использования ацетазоламида у больных с выраженной ХСН не проводились. Существует мнение, что ацетазоламид целесообразно применять при выраженной ХСН только в случаях развития устойчивости к действию петлевых и тиазидных диуретиков [25].
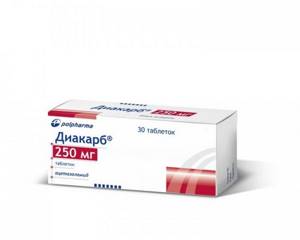
Применение ацетазоламида в этих ситуациях возможно как в виде таблеток по 250 мг 2—3 раза в день в течение 3—4 дней [9], так и в/в по 500 мг болюсно [25].
Гипохлоремия также может приводить к развитию неэффективности применения петлевых диуретиков. Сообщения о возможности применения ацетазоламида для устранения гипохлоремии, развившейся в результате применения фуросемида и спиронолактона, появились еще в начале 80-х годов ХХ века.
В 1980 г Khan M.I. et al. [45] сообщили об эффективности применения ацетазоламида для коррекции нормокалиемического гипохлоремического алкалоза, развившегося у больного 74 лет с выраженной ХСН на фоне применения фуросемида и спиронолактона.
При низкой концентрации хлоридов в крови (95 мэкв/л.
Применение ацетазоламида при лечении эпизодов центрального апноэ во сне
Среди причин развития центрального апноэ во сне выделяют альвеолярные гиповентиляционные нарушения, сердечную недостаточность, неврологические и автономные нарушения [47]. Существуют также идиопатические формы центрального апноэ во сне.
Больные с идиопатической формой центрального апноэ во сне часто жалуются на бессонницу и частые пробуждения ночью; может отмечаться сонливость в дневное время.
Дыхание типа Чейн-Стокса или периодическое дыхание нередко наблюдаются при ХСН и неврологических нарушениях, особенно при поражении стволовых структур мозга [47].
Апноэ определяют как прекращение вдыхаемого воздушного потока на 10 с и более.
Обструктивное апноэ проявляется отсутствием потока при наличии экскурсии грудной клетки и живота, а центральное апноэ отсутствием потока и экскурсии грудной клетки и живота [48—50].
Гипопноэ определяют как уменьшение вдыхаемого потока в течение ≥10 с, сопровождающееся снижением на 4% и более насыщения артериальной крови оксигемоглобином или пробуждением [51].
Распространенность центрального апноэ во время сна среди больных с ХСН достигает 40—45% [48, 52, 53].
К предрасполагающим факторам развития центрального апноэ во время сна у больных с ХСН относят гипокапнию и замедление кровотока, а также, возможно, изменение активности стволовых структур мозга [52, 54].
У больных с сочетанием ХСН и центрального апноэ во время сна наличие гипокапнии (напряжение CO2 в артериальной крови — PaCO2 ≤35 мм рт.ст.) в 20 раз увеличивает риск развития пароксизмов желудочковой тахикардии [55].
При одинаковой фракции выброса левого желудочка смертность больных с ХСН увеличивается при наличии нарушений дыхания по типу Чейн—Стокса [52]. Наиболее эффективными подходами к лечению в этих ситуациях считаются улучшение функции сердца, ингаляции O2 в ночное время и дыхание под повышенным давлением.
Поскольку метаболический ацидоз, вызываемый ацетазоламидом, стимулирует вентиляцию легких, предполагалось, что применение этого препарата будет эффективным при нарушениях дыхания во время сна [56]. Ацетазоламид нередко рекомендуют в качестве медикаментозной терапии для уменьшения выраженности центрального апноэ во время сна [47, 52, 57].
В исследовании, включавшем 14 больных с центральным апноэ во время сна, было показано, что даже однократный прием небольших доз ацетазоламида (по 250 мг за 1 ч до отхода ко сну) приводит к снижению индекса центрального апноэ с 25,5±6,8 до 13,8±5,2; продолжение терапии в течение 1 мес в той же дозе сопровождалось дальнейшим снижением индекса центрального апноэ до 6,6±2,9 [58].
Отмечена эффективность применения ацетазоламида для уменьшения частоты желудочковой экстрасистолии, возникающей на фоне эпизодов центрального апноэ [59].
В небольшом исследовании, включавшем 9 больных с обструктивным апноэ во сне, была показана возможность увеличения гиперкапнической, но не гипоксической стимуляции [60].
На основании результатов этого исследования было высказано предположение о том, что применение ацетазоламида оказывает положительное действие при нетяжелых случаях обструктивного апноэ за счет улучшения центрального контроля и стабилизирующего влияния на контроль вентиляции.
В то же время в другом, также небольшом исследовании, было отмечено, что на фоне применения ацетазоламида при смешанном типе апноэ во время сна возможно усиление обструктивного компонента апноэ при уменьшении центрального компонента [61].
Применение ацетазоламида при дыхательной и легочно-сердечной недостаточности у больных с хроническими обструктивными заболеваниями легких
Возможность улучшения газового состава крови при хронических обструктивных заболеваниях легких (ХОБЛ) на фоне использования ацетазоламида отмечалась при исходном метаболическом алкалозе, обусловленном применением кортикостероидных препаратов или диуретиков [62]. В этих случаях положительное действие ацетазоламида, вероятно, обусловлено увеличением стимуляции дыхания за счет метаболического ацидоза, который возникает при подавлении почечной карбоангидразы [63, 64].
В исследовании, включавшем здоровых добровольцев, было показано, что прием ацетазоламида (по 250 мг каждые 8 ч в течение 3 дней) приводил к увеличению объема вентиляции в покое с 12,22±2,41 до 14,01±1,85 л/мин и уменьшению максимального PаСО2 в конце спокойного выдоха с 40,0±4,7 до 33,3±3,5 мм рт.ст. [65]. Избыток оснований в крови снижался с –0,08±1,20 до –7,48±2,07 ммоль/л, что указывало на развитие метаболического ацидоза и объясняло уменьшение напряжения PаСО2 в крови.
В рандомизированном двойном слепом перекрестном исследовании, включавшем 19 больных с ХОБЛ и гиперкапнией, сравнивалась эффективность применения двух стимуляторов дыхания — ацетазоламида (по 250 мг 2 раза в день) и медроксипрогестерона ацетата (по 30 мг 2 раза в день) [10].
Оба препарата оказывали статистически значимое положительное влияние на показатели газового состава крови в течение суток.
Однако использование ацетазоламида, в отличие от медроксипрогестерона, сопровождалось статистически значимым улучшением насыщения кислородом артериальной крови (SaO2) в ночное время.
Был также проведен систематический обзор, посвященный оценке эффективности и безопасности применения ацетазоламида при лечении гиперкапнической дыхательной недостаточности у больных ХОБЛ [66]. Анализировались только плацебо-контролируемые исследования с участием больных со стабильной дыхательной недостаточностью на фоне ХОБЛ.
Всего для анализа были отобраны 4 исследования, которые включали 84 больных. Длительность наблюдения в среднем составила 2 нед. Во всех исследованиях была отмечена примерно одинаковая эффективность применения ацетазоламида.
В двух рандомизированных параллельных исследованиях применение ацетазоламида сопровождалось развитием метаболического ацидоза и вызывало статистически незначимое снижение PaCO2 (в среднем на 3,08 мм рт.ст. при 95% ДИ от –6,83 до 0,68) и статистически значимое увеличение PaO2 (в среднем на 11,55 при 95% ДИ от 7,28 до 15,83).
В одном исследовании было отмечено улучшение сна. Побочные эффекты встречались нечасто. Таким образом, полученные в ходе анализа данные указывают на то, что применение ацетазоламида при гиперкапнической дыхательной недостаточности у больных с ХОБЛ приводит к небольшому увеличению PaO2 и снижению PaCO2 [66].
Считается, что применение ацетазоламида как стимулятора дыхания при ХОБЛ должно ограничиваться редкими случаями острой гиперкапнии [67].
Следует отметить, что применение фуросемида при ХОБЛ может приводить к увеличению PaCO2, что сопровождается задержкой жидкости и уменьшением эффективности применения фуросемида [68].
Учитывая, что у многих больных с ХОБЛ фуросемид применяется довольно часто и длительно, возникающее за счет терапии увеличение PaCO2 становится клинически значимым. Если при ХОБЛ возникает необходимость в диуретической терапии целесообразно попытаться использовать другие типы диуретиков.
Считается, что в этих ситуациях может оказаться предпочтительнее применение спиронолактона, не влияющего на кислотно-щелочное равновесие, или ацетазоламида, приводящего к метаболическому ацидозу [68].
В небольшом исследовании, включавшем 10 больных с ХОБЛ, периферическими отеками и средним уровнем SaO2 в ночное время
Советы кардиолога при заболевании COVID-19
Часто пациенты, перенесшие новую коронавирусную инфекцию, предъявляют жалобы на боли или дискомфорт в области сердца, одышку, слабость, ощущения «перебоев» в работе сердца.
Действительно, COVID-19 может оказывать отрицательное влияние на функцию сердечно-сосудистой системы и приводить к повреждению миокарда. Вирус может вызывать повреждение сердечной мышцы (миокардит) или сердечной сумки (перикардит).
Ухудшает ситуацию тот факт, что для лечения COVID-19 применяют препараты, которые вызывают целый ряд кардиотоксических эффектов.
В первую очередь возникают нарушения ритма и проводимости, что может сопровождаться приступами ритмичного или неритмичного сердцебиения, обмороками или предобморочными состояниями.
Появившиеся симптомы могут быть следствием приема некоторых противовирусных, антибактериальных, противомалярийных препаратов, а также их комбинаций.
Несколько полезных советов от нашего врача-кардиолога, к.м.н., Канюковой Анастасии Александровны помогут вам:
- Во время заболевания избегать физических нагрузок. Вернуться к интенсивным тренировкам можно будет спустя 2-3 месяца после выздоровления, желательно после предварительного ЭКГ-обследования. Умеренные нагрузки можно начинать раньше, но при условии полного отсутствия жалоб.
- Избегать приема кардиотоксических препаратов. Прием антибиотиков – только по назначению врача! Уже накоплен опыт отсутствия эффекта от использования антибиотиков при неосложненном течении COVID-19. По этой же причине в период заболевания и восстановления лучше избегать приема алкоголя, кофе, кофеинсодержащих БАДов, энергетиков. Если у вас есть нарушения ритма, проводимости или иная сердечно-сосудистая патология, а в процессе лечения возникла необходимость в назначении антибиотика, противомалярийного препарата, сообщите о наличии заболевания врачу. В этом случае доктор может пересмотреть тактику, заменить препарат или провести дополнительное ЭКГ-обследование.
- Ни в коем случае не отменять препараты для снижения давления, холестерина (статины) и разжижения крови (оральные антикоагулянты и дезагреганты), если они были назначены до заболевания COVID-19! Эти препараты снижают риск развития осложнений у пациентов с хроническими заболеваниями. Людям с повышенным артериальным давлением в период заболевания и восстановления стоит уделить особое внимание контролю давления. На фоне инфекции АД выходит из-под контроля и может потребоваться коррекция дозировок препаратов или добавление новых.
- Антикоагулянты, дезагреганты при лечении дома показаны не всем, поэтому не нужно использовать их без показаний. Помимо риска кровотечений, которые могут нести угрозу для жизни, дезагреганты, например, могут вызывать эрозивно-язвенное поражение слизистой желудка, а также провоцировать обострение хронического панкреатита или аспириновой астмы.
Если у вас возникли вопросы относительно лечения, сохраняются или появляются новые жалобы, советуем незамедлительно обратиться к специалисту.
Есть вопросы? Напишите доктору.
Блокада ренин-ангиотензин-альдостероновой системы у пациентов с высоким кардиоваскулярным риском и коморбидными состояниями. Линотор® | Медичний часопис
Резюме. Статья содержит обзор современных представлений о медикаментозной тактике ведения пациентов с высоким кардиоваскулярным риском в рамках концепции гиперактивации ренин-ангиотензин-альдостероновой системы как патофизиологической основы сердечно-сосудистого континуума.
Рассмотрены базовые принципы фармакологической блокады ренин-ангиотензин-альдостероновой системы в клинической практике с акцентом на особенностях гидрофильного ингибитора ангиотензинпревращающего фермента лизиноприла и преимуществах его применения у больных с коморбидными состояниями.
В настоящее время общепризнанной стратегией лечения больных с артериальной гипертензией (АГ) является не столько достижение контролируемого артериального давления (АД), сколько предупреждение и/или максимально возможное отдаление во времени поражения органов-мишеней.
Следствием такого поражения является развитие сердечно-сосудистых осложнений и тяжелых клинических состояний — прогрессирующего атеросклероза, аритмии, инфаркта миокарда (ИМ), мозгового инсульта, хронической сердечной недостаточности (ХСН), хронической почечной недостаточности (ХПН).
Согласно последним Рекомендациям Европейского общества по артериальной гипертензии и Европейского кардиологического общества (European Society of Hypertension/European Society of Cardiology — ESH/ESC) 2007 г. и их пересмотру 2009 г.
, современные подходы к ведению пациентов с АГ базируются на стратификации индивидуального кардиоваскулярного риска пациента и формировании медикаментозной тактики ведения больного с учетом уровня АД, факторов риска, субклинического поражения органов-мишеней и ассоциированных клинических состояний — сопутствующих заболеваний сердечно-сосудистой системы и почек (Mancia G. et al., 2007; 2009).
В докладе ESH по итогам семинара, проведенного в сентябре 2009 г.
и посвященного анализу существующих клинических и экономических барьеров на пути к широкому внедрению во врачебную практику превентивной терапии, отмечено, что фундаментальной основой современных клинических подходов, в особенности на уровне первичного звена, должны стать тщательная оценка кардиоваскулярного риска пациента и определение конечных клинических целей. Особый акцент сделан на повышении качества стратификации индивидуального риска пациента и применении всего арсенала средств, соответствующих как степени риска, так и достижению индивидуальных целей для каждого больного (Zannad F. et al., 2012).
Органопротекторный аспект клинических протоколов лечения пациентов с АГ, формирующихся с позиций доказательной медицины, базируется на концепции сердечно-сосудистого континуума.
Эта концепция, предложенная V. Dzau и E. Braunwald в 1991 г., на сегодняшний день является общепризнанной в понимании развития важнейших сердечно-сосудистых заболеваний и обосновании превентивной медикаментозной терапии.
Патофизиологический каскад сердечно-сосудистого континуума
Концепция сердечно-сосудистого континуума отражает прогрессирующую цепь патогенетических событий, развитие которых происходит на протяжении десятков лет жизни человека.
Пусковым звеном сердечно-сосудистого континуума является ряд специфических состояний — факторов кардиоваскулярного риска, к которым относят АГ, сахарный диабет (СД), дислипидемию, абдоминальное ожирение, курение (Dzau V., Braunwald E., 1991).
Ключевыми этапами развития сердечно-сосудистого континуума являются активация нейрогормональных систем, дисфункция эндотелия и ремоделирование органов (Dzau V. et al., 2006).
Непрерывная цепь взаимосвязанных функциональных и структурных изменений в различных органах и системах в рамках сердечно-сосудистого континуума предполагает наличие общих патофизиологических процессов, среди которых важнейшим является активация ренин-ангиотензин-альдостероновой системы (РААС), которая по сути является матрицей сердечно-сосудистого континуума. Активация этого нейрогуморального комплекса играет ключевую роль в патогенезе АГ, ее осложнений и метаболических нарушений на всех этапах сердечно-сосудистого континуума (Кобалава Ж.Д., 2008).
Фокусирование клинических усилий на модификации факторов риска, являющихся ранними компонентами сердечно-сосудистого континуума, предоставляет возможность затормозить прогрессирующее развитие сердечно-сосудистых заболеваний на ранних этапах, поскольку в более поздних стадиях (атеросклероз, ИМ и сердечная недостаточность (СН)) достижение обратного развития в органах-мишенях или замедление прогрессирования заболевания является труднодостижимой задачей (Cheung B.M., 2006).
Активация РААС как предиктор прогрессирующего течения сердечно-сосудистых заболеваний
C момента открытия ренина в 1898 г. в историю изучения РААС вписан целый ряд ярких и в некотором роде драматических страниц — признание прессорной роли ренина мировой научной общественностью в 1934 г., открытие ангиотензиногена, ангиотензина I, ангиотензинпревращающего фермента (АПФ) и, наконец, главного эффектора системы — ангиотензина II (Atlas S.A., 2007).
Современные представления о РААС значительно расширены за счет открытия новых компонентов системы и путей их активации. В классическом определении РААС является пептидергической системой с эндокринными характеристиками (Atlas S.A., 2007).
Субстрат системы — ангиотензиноген — образуется в печени и под воздействием ренина, образующегося в клетках юкстагломерулярного аппарата почек, расщепляется в циркулирующем русле крови до декапептида ангиотензиногена I.
Последний под воздействием АПФ (металлопротеиназы, содержащейся в большом количестве на поверхности эндотелиальных клеток легочного сосудистого русла) трансформируется в октапептид ангиотензин II (Paul М. et al., 2006; Atlas S.A., 2007).
Ангиотензин II, являющийся основным эффекторным гормоном РААС, впоследствии воздействует на специфические ангиотензиновые рецепторы и вызывает различные физиологические и патофизиологические эффекты.
Наиболее изученными из них являются эффекты, связанные с активацией АТ1-рецепторов к ангиотензину II, — кардиоваскулярные (вазоконстрикция, повышение АД, гипертрофия сосудистой стенки и миокарда, повышение сократимости миокарда), почечные (канальцевая реабсорбция натрия, подавление синтеза ренина), симпатоадреналовые (активация симпатоадреналовой системы, стимуляция секреции альдостерона в коре надпочечников) (Carey R.M., Siragy H.M., 2003; Paul М. et al., 2006; Atlas S.A., 2007).
АТ1-рецепторы также опосредуют эффекты ангиотензина II в отношении клеточного роста, пролиферации, воспалительного ответа и оксидативного стресса (Atlas S.A., 2007). Эти рецепторы, являющиеся типичными представителями семейства G-белок-сопряженных рецепторов (G-protein-coupled receptors), широко представлены на мембранах большинства клеток в органах-мишенях.
Представления о РААС, сформированные в течение десятилетий, претерпели существенные изменения в связи с последними открытиями ученых, которые значительно усложнили прежнее видение системы: открыты различные рецепторы к ангиотензину II (АТ1, АТ2, АТ3, АТ4) и различные пути их активации, выявлен укороченный пептид — гептапептид ангиотензин (1–7), расценивающийся в настоящее время как эндогенный иАПФ с эффектами, противоположными ангиотензину II, определены альтернативные пути активации ангиотензина II, в том числе химазный (Atlas S.A., 2007; Santos R.A. et al., 2008).
Ключевым моментом трансформации прежних представлений о системе стало введение концепции локальной, или тканевой, РААС и тканевого синтеза ангиотензина II в связи с выявлением ренина, типичного «почечного энзима», в «нетипичных» органах — миокарде, периферических сосудах, мозгу, жировой ткани, надпочечниках, коже (Phillips M.I., 1999; Carey R.M., Siragy H.M., 2003).
Скептическое отношение многих ученых к данной концепции было преодолено достижениями в двух областях — молекулярной биологии и молекулярной генетике (Paul M. et al., 2006).
Выделение компонентов РААС из циркулирующей крови и различных тканей позволило сформировать концепцию о РААС как о двухкомпонентной системе, состоящей из циркулирующего и тканевого (паракринного/аутокринного) звеньев (Phillips M.I., 1999; Atlas S.A., 2007).
Циркулирующее звено РААС как система «быстрого реагирования» обеспечивает кратковременный контроль сердечно-сосудистого и почечного гомеостаза, например компенсаторные реакции при возникновении гипертензивного криза, острой СН за счет кратковременных эффектов — вазоконстрикции, повышения АД, задержки жидкости, активации гликогенолиза и т.д. (Журавлева Л.В., Лопина Н.А., 2011).
Локальная (тканевая) РААС, представленная в органах-мишенях (сердце, почках, мозгу, сосудах) — это система длительного регулирования, обеспечивающая тоническое медленное действие на структуру и функции органов (Журавлева Л.В., Лопина Н.А., 2011).
Помимо АГ, долгосрочные эффекты повышенной продукции ренина, ангиотензина II и симпатического гипертонуса включают развитие дислипидемии, нарушений сердечного ритма, гиперкоагуляции, эндотелиальной дисфункции, инсулинорезистентности, увеличение массы тела (Кобалава Ж.Д., 2008).
Именно тканевое звено РААС ответственно за развитие органных поражений. Компоненты локальной РААС вовлечены в процессы клеточного роста, пролиферации, апоптоза, перекисного окисления липидов, секреции гормонов, а также обладают провоспалительными и профибротическими свойствами (Журавлева Л.В., Лопина Н.А., 2011).
Гиперактивация РААС в органах-мишенях стимулирует процессы, получившие название ремоделирования органов и тканей. Гипертрофия, пролиферация гладкомышечных клеток периферических сосудов сопровождаются развитием атеросклероза. В мозгу это приводит к ускорению атеросклеротического поражения сосудов и развитию инсульта (Журавлева Л.В., Лопина Н.А., 2011).
Пролиферативные процессы в миокарде сопровождаются развитием фиброза миокарда и гибелью кардиомиоцитов (некроз и/или апоптоз), ремоделированием сердца с развитием симптомов ХСН (Atlas S.A., 2007).
В почках хроническая активация локальной РААС сопровождается дисфункцией эндотелия клубочковых капилляров и нарушением проницаемости их стенки, уменьшением площади фильтрационной поверхности, прогрессирующим снижением скорости клубочковой фильтрации (СКФ) и развитием ХПН (Carey R.M., Siragy H.M., 2003; Paul M. et al., 2006; Atlas S.A., 2007).
В печени гиперактивация тканевой РААС вызывает развитие и прогрессирование фиброза (Bataller R. et al., 2000; Warner F.J. et al., 2007; Pereira R.M. et al., 2009).
Таким образом, возникновение АГ и ее прогрессирование, сосудистое и органное ремоделирование с развитием необратимых системных повреждений и терминальных клинических состояний непосредственно связаны с гиперактивацией циркулирующего и тканевого звеньев РААС (Dzau V.J. et al., 2006).
Исследования в отношении «нетипичных» эффектов ангиотензина II в последнее время приобретают особенно интенсивный характер.
Значительное количество полученных данных свидетельствуют о существовании множественных органных РААС с самыми различными физиологическими функциями.
Выявлены прямые воздействия ангиотензина II на клеточном уровне, влияющие на клеточный рост и клеточную дифференцировку. Вместе с тем ангиотензин II может выступать и в роли медиатора апоптоза (Paul М. et al., 2006).
Эти универсальные паракринные и аутокринные эффекты ангиотензина II могут играть важнейшую роль в деятельности многих органов и систем и опосредовать важные физиологические и патофизиологические реакции.
Обобщение этих данных приобретает возрастающую значимость в изучении физиологии органов, а также в формировании новых взглядов на возможность применения этих данных в патофизиологии и клинической медицине (Paul М.
et al., 2006).
Клинические аспекты сердечно-сосудистого континуума
Применение антигипертензивных лекарственных препаратов и статинов в современных схемах лечения подтверждает клиническую целесообразность концепции сердечно-сосудистого континуума с возможностью предупреждения эскалации сердечно-сосудистых заболеваний и снижения риска развития таких фатальных и нефатальных осложнений, как ИМ и мозговой инсульт, путем эффективной медикаментозной коррекции факторов риска и блокады РААС (Cheung B.M., 2006).
Как указано выше, стратегия индивидуального риска является основой современной медикаментозной и немедикаментозной терапии АГ, в фокусе которой — конкретный пациент с индивидуальным комплексом фоновых состояний, генетических детерминант, факторов риска и приобретенных заболеваний.
Стратификация кардиоваскулярного риска, разработанная ESH и включенная в национальные руководства по лечению АГ большинства стран Европы, предлагает скрининговое применение доступных и легко воспроизводимых биомаркеров в качестве инструментов оценки кардиоваскулярного риска, которые с наибольшей вероятностью отражают степень нейрогуморальной активации у конкретного пациента.
В соответствии с Рекомендациями ESH/ESC 2007 г. и их пересмотром 2009 г., наибольшего внимания при выборе медикаментозной тактики ведения требуют пациенты с высоким и очень высоким кардиоваскулярным риском. К ним относятся пациенты с:
- уровнем систолического АД ≥180 мм рт. ст. и/или диастолического АД ≥110 мм рт. cт.; уровнем систолического АД >160 мм рт. ст. при диастолическом АД